Atom pada dasarnya adalah unit materi terkecil yang mempertahankan semua sifat kimia dan fisika suatu unsur. Oleh karena demikianlah atom akan seantiasa bergabung membentuk molekul yang kemudian berinteraksi membentuk padatan, gas, atau cairan. Setiap jenis penyusun dalam arti partikel atom terdiri dari satu inti dan satu atau lebih elektron yang terikat ke inti. Inti terdiri dari satu atau lebih proton dan sejumlah neutron. Akan tetapi anya jenis ikatan hidrogen yang paling umum yang tidak memiliki neutron.
Dimana lebih dari 99,94% massa atom ada di dalam inti atom. Proton memiliki muatan listrik positif, elektron memiliki muatan listrik negatif, dan neutron tidak memiliki muatan listrik. Jika jumlah proton dan elektronnya sama, maka atom tersebut netral secara elektrik. Misalnya, arti air terdiri dari atom hidrogen dan sifat oksigen yang bergabung membentuk molekul air.
Atom
Atom adalah struktur penentu suatu unsur yang kebaradaannya tidak dapat dipecah dengan cara kimiawi apa pun. Sebuah atom terdiri dari inti proton yang bermuatan positif, neutron yang bermuatan netral secara elektrik, dan elektron yang bermuatan negatif yang mengorbit inti ini.
Adapun untuk teori atom dalam sejarah penemuan atom yang paling termashur penumuanya sampai sekarang ada Dalton, Thomson, Rutherford, dan Bohr.
Jenis Partikel Atom
Penyusun atom terdiri dari tiga partikel dasar. Yaitu proton (bermuatan positif), elektron (bermuatan negatif), dan neutron (tanpa muatan). Berikut ini penjelasan singkat terkait macam-macam partikel penyusun yang membentuk atom. Antara lain;
-
Proton
Proton ialah partikel atom yang memiliki muatan positif yang terdapat di dalam inti atom. Rutherford menemukannya dalam eksperimen dengan tabung sinar katoda yang dilakukan antara 1911 dan 1919. Proton sekitar 99,86% lebih masif dari neutron.
Jumlah proton dalam atom unik untuk setiap unsur atomnya. Misalnya, atom karbon mempunyai 6 proton, atom hidrogen mempunyai 1 proton, dan atom oksigen mempunyai 8 proton.
Jumlah proton dalam sebuah atom disebut sebagai nomor atom dari unsur tersebut. Jumlah proton juga menentukan sifat kimiawi unsur tersebut. Unsur disusun dalam Tabel periodik unsur dalam urutan nomor atomnya bertambah.
-
Neutron
Keberadaan neutron diteorikan oleh Rutherford pada 1920 dan ditemukan oleh Chadwick pada 1932, menurut American Physical Society. Neutron ditemukan selama percobaan ketika atom ditembakkan pada selembar tipis berilium.
Partikel subatom tanpa muatan dilepaskan, yang dikenal dengan neutron. Neutron adalah partikel tak bermuatan yang ditemukan di dalam semua inti atom (kecuali hidrogen). Neutron mempunyai massa yang sedikit lebih besar daripada proton.
-
Elektron
Elektron lebih kecil dibandingkan dengan proton dan neutron, lebih dari 1.800 kali lebih kecil daripada proton atau neutron. Elektron sekitar 0,054% lebih masif dari neutron. Joseph John (J.J.) Thomson, seorang fisikawan Inggris, menemukan elektron pada tahun 1897. Awalnya dikenal sebagai “corpuscles,” elektron memiliki muatan negatif dan secara elektrik tertarik ke proton yang bermuatan positif.
Elektron mengelilingi inti atom dalam jalur yang disebut orbital, sebuah gagasan yang dikemukakan oleh Erwin Schrodinger, seorang fisikawan Austria, pada 1920-an. Saat ini, model ini dikenal sebagai model kuantum atau model awan elektron. Orbital dalam yang mengelilingi atom berbentuk bola tetapi orbital luar jauh lebih rumit.
Konfigurasi elektron atom mengacu pada lokasi elektron dalam atom tertentu. Dengan menentukan konfigurasi elektron dan prinsip fisika, ahli kimia dapat memprediksi sifat atom, seperti stabilitas, rumus titik didih, dan konduktivitas.
Contoh Atom
Salah satu contoh atom misalnya saja;
-
Hidrogen
Nomor atom hidrogen adalah 1 nuklesunya mengandung 1 proton. Atom dalam ciri ikatan hidrogen juga memiliki 1 elektron. Karena memiliki jumlah proton yang sama dengan elektron, atom hidrogen bersifat netral (muatan positif dan negatif saling menghilangkan).
Namun, kira-kira satu dari 6.000 atom hidrogen mengandung neutron di intinya. Atom-atom ini tetaplah hidrogen, karena mereka memiliki satu proton dan satu elektron. Hidrogen hanya memiliki neutron yang tidak dimiliki sebagian besar atom hidrogen. Jadi atom ini disebut isotop.
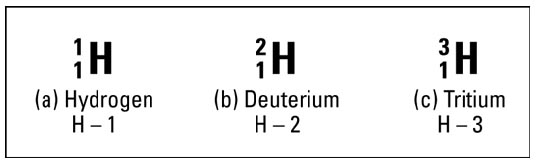
Diagram bagian (b) menunjukkan isotop hidrogen, yang disebut deuterium. Itu tetap hidrogen, karena hanya mengandung satu proton, tetapi berbeda dengan hidrogen di bagian (a), karena ia juga memiliki satu neutron.
Karena itu mengandung satu proton dan satu neutron, nomor massanya adalah dua Bahkan ada isotop hidrogen yang mengandung dua neutron. Yang ini disebut tritium, dan diwakili di diagaram bagian (c). Tritium tidak terjadi secara alami di bumi, tetapi dapat dengan mudah dibuat.
Sekarang mungkin kita bertanya-tanya, “Jika kita melakukan kalkulasi yang melibatkan massa atom hidrogen, isotop manakah yang saya gunakan?” Kita menggunakan rata-rata dari semua isotop hidrogen yang terjadi secara alami. Tapi bukan rata-rata sederhana.
Kita harus mempertimbangkan bahwa ada lebih banyak H-1 daripada H-2, dan kita bahkan tida mempertimbangkan H-3, karena itu tidak terjadi secara alami. Kita menggunakan rata-rata tertimbang, yang mempertimbangkan kelimpahan isotop yang terjadi secara alami.
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa atom menjadi suatu penyusun dasar dari senyawa organik, anorganik, dan organometalik. Bahkan pemanfaatnya dapat dilihat dari kita bangun tidur, proses selama kita bangun, melakukan aktivitas sehari hari seperti minum air, mandi, memasak makanan, membersihkan mobil, tertawa atau menangis semuanya terjadi karena adanya proses kimia yang berbeda dalam tubuh kita.
Nah, itulah saja artikel yang bisa kami kemukakan pada semua pembaca berkaitan dengan macam-macam penyusun partikel pada atom dan contohnya yang ada dalam kehidupan sehari-hari. Semoga memberi edukasi untuk semua kalangan yang membutuhkan.