Larutan penyangga atau disebut dengan buffer adalah salah satu jenis larutan elektrolit yang sangat penting dalam kehidupan. Disinilah terlihat, apakah anda pernah membayangkan bagaimana cara tubuh manusia mempertahankan kondisi pH nya tetap netral, karena ketika pH darah manusia mengalami kenaikan atau penurunan yang drastis akan menyebabkan kematian.
Tubuh manusia menerapkan sistem buffer sebagai larutan untuk mempertahankan pH darah tetap pada kondisi netral. Oleh karena itu larutan penyangga ini sangat bermanfaat bagi kehidupan. Dalam artikel ini akan dibahas tentang pengertian larutan penyangga atau buffer, sistem buffer dalam tubuh, rumus dan perhitungan pH pada larutan penyangga, serta contohnya.
Larutan Penyangga/Buffer
Diakui atupun tidak, ketika suatu larutan mengalami penambahan asam atau basa maka pHnya akan berubah dengan drastis, namun dengan adanya larutan penyangga ini penambahan asam atau basa ke dalam larutan hanya akan mengubah sedikit pH larutan tersebut dan perubahannya tidak signifikan.
Oleh karena itu maka dalam larutan penyangga ini banyak digunakan sebagai larutan untuk menjaga suatu larutan supaya memiliki pH yang cenderung tetap dengan berbagai perlakuan kimia.
Namun pada aplikasinya, pemilihan larutan buffer untuk mempertahankan pH larutan didasarkan pada rentang pH yang dapat dinetralkan oleh larutan itu sendiri. Rentang pH itu adalah jumlah asam atau basa maksimum yang dapat ditambahkan ke dalam larutan sebelum mengubah pH atau disebut dengan kapasitas buffer.
Pengertian Larutan Penyangga
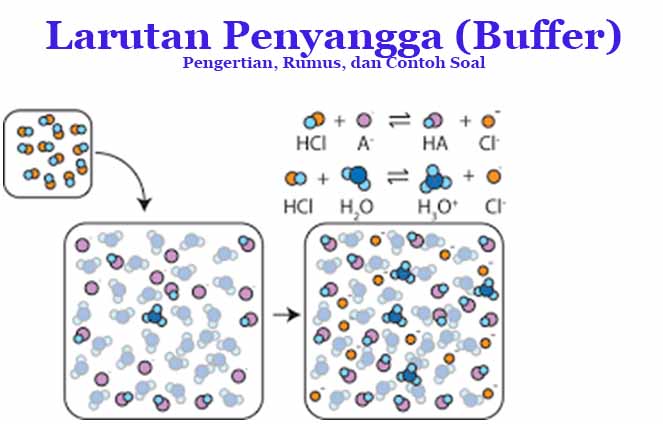
Larutan penyangga adalah larutan yang mengandung asam lemah dan basa konjugasinya atau basa lemah dan asam konjugasinya yang tahan terhadap perubahan pH. Dengan kata lain, buffer adalah larutan yang mampu mempertahankan kondisi pH suatu larutan.
Pengertian Larutan Penyangga Menurut Para Ahli
Adapun definisi larutan penyangga menurut para ahli, antara lain;
- NA Ismayanti (2019), Pengertian larutan penyangga atau dikenal dengan buffer adalah bagian daripada jenis larutan yang senantisa dipergunakan untuk mempertahankan nilai pH tertentu dari perlakuan sedikit asam.
Rumus Kesimbangan Larutan Penyangga (Buffer)
Suatu larutan penyangga dapat mempertahankan pH larutan atau resistan terhadap perubahan pH karena adanya kesetimbangan antara asam (HA) dan juga basa konjugasinya (A–). Persamaan yang menggambarkannya yaitu sebagai berikut:
HA ⇌ H+ + A−
Ketika asam kuat ditambahkan maka H+ akan bertambah dalam sistem kesetimbangan tersebut sehingga akan bergeser ke kiri sesuai dengan prinsip Le Chatelier. Hal ini menyebabkan konsentrasi H+ meningkat. Demikian pula jika basa kuat ditambahkan maka konsentrasi ion hidrogen H+ akan berkurang sehingga kesetimbangan akan bergeser ke arah kanan.
Jenis Larutan Penyangga
Pada umumnya larutan penyangga atau buffer dibagi menjadi dua macam yaitu buffer asam dan buffer basa.
-
Buffer Asam
Sesuai namanya, buffer asam adalah buffer yang ditambahkan untuk mempertahankan suasana asam dalam suatu larutan. Buffer asam ini memiliki pH dibawah 7 dimana pada pH tersebut merupakan pH asam. Buffer asam dapat terbentuk dari campuran larutan asam lemah dengan garam basa konjugasinya atau dapat juga terbentuk dari campuran asam lemah berlebih dengan basa kuat lainnya.
Contoh larutan buffer asam dari campuran asam lemah dengan garam basa konjugasi yaitu larutan CH3COOH yang merupakan asam lemah dan ditambah dengan CH3COONa yang merupakan garam basa konjugasinya yang dapat menghasilkan ion CH3COO–.
CH3COOH (aq) ⇌ CH3COO− (aq) + H+ (aq)
Contoh dari buffer asam dari campuran asam lemah dengan basa kuat yaitu larutan CH3COOH yang berlebih dicampurkan dengan basa kuat NaOH sehingga akan menghasilkan garam basa konjugasi.
CH3COOH (aq) + NaOH (aq) ⇌ CH3COONa (aq) + H2O (l)
-
Buffer Basa
Jika buffer asam mampu mempertahankan larutan asam, maka buffer basa adalah lawannya dimana buffer basa merupakan larutan yang mampu mempertahankan pH dari larutan yang bersifat basa. Buffer basa ini dapat terbentuk dari campuran larutan basa lemah berlebih dengan garam asam konjugasinya atau dari campuran basa lemah dengan asam kuat.
Contoh buffer basa yang terbentuk dari campuran basa lemah degan garam asam konjugasinya yaitu campuran antara NH3 yang merupakan basa lemah dengan NH4Cl yang merupakan garam asam konjugasi dari NH3.
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
Contoh buffer basa dari campuran basa lemah dengan asam kuat yaitu campuran antara larutan NH3 berlebih yang merupakan basa lemah dengan HNO3 yang merupakan asam kuat sehingga akan membentuk garam asam konjugasi dari NH3.
NH3 (aq) + HNO3 (aq) ⇌ NH4NO3 (aq)
Rumus Perhitungan Larutan Penyangga/Buffer
Adapun untuk rumus-rumus yang biasa dipergunakan dalam perhitungan larutan penyelenggara khusus untuk pH nya, antara lain adalah sebagai berikut;
-
Larutan Penyangga Asam
Pada larutan penyangga asam terdapat kesetimbangan antara asam dengan garam basa konjugasinya, sebagai contoh:
CH3COOH ⇌ H+ +CH3COO–
Berdasarkan persamaan reaksi tersebut maka dapat ditentukan nilai Ka

Dimana nilai Ka pada umumnya telah diketahui dan mol asam lemah serta basa konjugasi juga dapat ditentukan.
Jika nilai [H+] telah diketahui, maka pH dapat ditentukan melalui rumus berikut:
pH = – log [H+]
-
Larutan Penyangga Basa
Pada larutan penyangga basa terdapat kesetimbangan antara basa lemah dengan garam asam konjugasinya, sebagai contohnya:
NH3 + H2O ⇌ NH4+ + OH–
Berdasarkan persamaan reaksi tersebut maka dapat ditentukan nilai Kb

Dimana nilai Kb pada umumnya telah diketahui dan mol basa lemah serta asam konjugasi juga dapat ditentukan.
Jika nilai [OH–] telah diketahui, maka pOH dapat ditentukan melalui rumus berikut:
pOH = – log [OH–]
Sedangkan nilai pH dapat dihitung dengan rumus berikut:
pH + pOH = 14
Maka
pH = 14 – pOH
Sistem Buffer pH dalam Tubuh Manusia
Seperti yang telah disinggung sebelumnya bahwa tubuh manusia perlu mempertahankan pH darah untuk tetap dalam pH netral karena ketika pH darah mengalami kenaikan atau penurunan drastis dapat menyebabkan kematian.
Oleh karena itu di dalam tubuh manusia, buffer pH darah memiliki peran yang sangat besar dalam mempertahankan kehidupan manusia. Tubuh manusia menggunakan buffer asam lemah yaitu asam karbonat H2CO3 dengan garam basa konjugasinya yaitu HCO3–. Sistem buffer ini mampu menjaga pH darah manusia dalam rentang 7.35-7.45 sehingga tetap aman.
Ketika di dalam darah terdapat asam yang cukup kuat maka H+ dari asam tersebut akan bereaksi dengan HCO3– atau garam basa konjugasi melalui arti reaksi kimia:
H+ + HCO3– ⇌ H2CO3
Namun ketika dalam tubuh kita terdapat basa yang cukup tinggi maka OH– dari basa tersebut akan bereaksi dengan H2CO3 melalui reaksi berikut :
OH– + H2CO3 ⇌ HCO3– + H2O
Melalui adanya sistem buffer tersebut maka pH dalam darah manusia tetap dapat bertahan pada kondisi mendekati netral meskipun adanya zat asam maupun basa yang masuk ke dalam tubuh.
Contoh Soal Larutan Penyangga (Buffer)
Agar memperjelas tentang larutan penyangga/buffer ini, maka berikut ini adalah contoh soal serta jawaban yang bisa diberikan. Anatara lain;
Nah, itulah tadi artikel yang memberikan penjelasan serta pengulasan terkait dengan pengertian larutan penyangga menurut para ahli, sistem, rumus perhitungan, contoh soal dan jawabannya. Semoga melalui tulisan ini bisa memberikan wawasan serta menambah pengetahuan pembaca sekalian.