Termokimia menjadi kajian penerapan kimia yang menjelaskan tentang perubahan energi pada definisi reakasi kimia. Stadi ini menjcangkup tentang energi yang sangat diperlukan. Lantaran dengan mengetahui energinya maka kita dapat memperkirakan untuk aplikasi dan efisiensi dari reaksi tersebut dalam kehidupan sehari-hari.
Contohnya saja ketika anda menyalakan suatu korek api, maka dalam peristiwa tersebutlah setidaknya terjadi perubahan energi dan materi melalui adanya karakteristik reaksi kimia yaitu reaksi pembakaran.
Termokimia
Termokimia akan terjadi manakala terdapat perubahan entalpi yang disertai pada suatu reaksi secara persamaan. Prihal inilah untuk mendefinisikan sistem dan lingkungan dalam kajian termokimia menjadi konsep dasar. Alasannnya karena objek yang sedang diamati atau dipelajari sedangkan lingkungan adalah bagian diluar sistem yang masih berinteraksi dengan sistem tersebut.
Pengertian Termokimia
Termokimia adalah salah satu cabang ilmu kimia yang mempelajari tentang panas dalam reaksi, dimana untuk suatu reaksi kimia selalu melibatkan energi untuk terjadinya reaksi tersebut dan reaksi juga dapat menghasilkan energi dari panas tertentu.
Pengertian Termokimia Menurut Para Ahli
Adapun definisi termokimia menurut para ahli, antara lain;
- Wahyu Sriyanto (2020), Termokimia adalah cabang studi kimia yang mengulas tentang adanya perubahan energi pada bentuk perubahan kimia dan fisika dalam mengelola kemampuan untuk melakukan kerja. Prihal ini tentusaja energi tidak dapat diciptakan dan tidak dapat dimusnahkan, energi hanya dapat berubah dari bentuk satu ke bentuk yang lain.
Bentuk Sistem dalam Kimia

Jenis sistem dan lingkungan ini dapat mempengaruhi termokimia suatu reaksi. Yakni;
-
Sistem Terbuka
Sesuai namanya, sistem terbuka adalah sistem yang secara bebas memungkinkan terjadinya pertukaran baik materi ataupun energi dari sistem tersebut dengan lingkungannya.
Sistem terbuka ini dapat dicontohkan yaitu ketika anda merebus air dengan menggunakan panci yang terbuka maka energi dan zat dapat dengan mudah berpindah ke lingkungan seperti halnya energi panas yang mengalir ke lingkungan dan zat yang berupa uap air yang juga berpindah ke lingkungan dari sistem dalam panci.
-
Sistem Tertutup
Sistem tertutup merupakan suatu sistem kimia yang memungkinkan untuk sistem tersebut melakukan pertukaran energi dengan lingkungan namun tidak dapat melakukan pertukaran materi karena sistem tersebut yang tertutup.
Sistem ini contohnya yaitu ketika anda merebus air dengan panci yang tertutup dimana pada kondisi tersebut panas tetap dapat bertukar dari sistem ke lingkungan, namun materi atau zat dari sistem tidak dapat keluar sehingga dinamakan tertutup.
-
Sistem Terisolasi
Selain kedua sistem diatas, terdapat satu jenis sistem yaitu sistem terisolasi dimana pada sistem ini pertukaran baik energi maupun materi tidak dimungkinkan.
Adapun untuk contoh sistem ini yaitu pada termos untuk menyimpan air panas dimana materi tidak dapat berpindah ke lingkungan begitu pula energi atau panas sistem yang terisolasi atau tidak dapat juga berpindah ke lingkungan.
Objek Studi Termokimia
Untuk objek studi yang ada dalam termokimia, yakni;
-
Energi
Energi adalah suatu potensi yang dapat digunakan untuk melakukan suatu work seperti menggerakkan benda, mengangkat benda, menghasilkan listrik, menaikkan suhu atau panas suatu sistem, dan lain-lain. Energi menjadi suatu kekuatan yang mampu mendorong terjadinya perubahan.
Adanya perubahan yang terjadi disebabkan oleh keterlibatan energi dimana energi ini bisa berada dalam bentuk cahaya, panas, energi listrik, dan lain-lain. Suatu energi tidak dapat dimusnahkan maupun diciptakan, energi hanya dapat berpindah dari satu bentuk misalnya ke bentuk lain, ini merupakan prinsip dasar konservasi energi.
Dalam kimia, energi selalu terlibat dalam terjadinya reaksi kimia karena untuk menyebabkan suatu zat atau reaktan dapat saling bereaksi dengan reaktan lain, maka dibutuhkan suatu energi minimum yang biasa disebut energi aktivasi.
Energi aktivasi tersebut adalah energi minimum yang harus dicapai oleh suatu zat sehingga dapat terjadi reaksi dan perubahan secara kimia. Selain itu, energi juga dapat dihasilkan dari sautu reaksi kimia. Ketika suatu reaksi menghasilkan panas tertentu maka panas tersebut merupakan jenis energi yang dihasilkan oleh reaksi.
-
Entalpi Reaksi
Dalam termokimia, istilah yang paling sering digunakan adalah entalpi yang biasa dilambangkan dengan (). Entalpi reaksi merupakan banyaknya panas yang terlibat dalam suatu reaksi kimia dimana reaksi tersebut dilakukan dalam suatu keadaan tertentu.
Sebagai contoh ketika anda melakukan reaksi pembakaran yaitu pembakaran gas metana (CH4) menggunakan O2 maka akan dihasilkan panas dimana panas tersebut merupakan entalpi dari reaksi pembakaran gas metana. Namun selain melepaskan panas, suatu reaksi juga dapat menyerap panas sehingga reaksi tersebut akan mengambil panasnya dari lingkungan.
Panas suatu reaksi atau entalpi reaksi juga dapat dibedakan untuk tiap reaksinya seperti panas reaksi pembentukan, panas reaksi pembakaran, panas reaksi penetralan, panas reaksi dekomposisi, dan lain-lain.
Jenis Reaksi dalam Termokimia
Pada dasarnya terdapat dua jenis reaksi kimia yang fokus dalam termokimia. Yaitu reaksi eksoterm dan reaksi endoterm. Penjelasannya;
-
Reaksi Eksoterm
Reaksi eksoterm adalah suatu reaksi dimana pada reaksi tersebut akan melepaskan suatu panas. Reaksi eksoterm ini ditandai dengan nilai entalpi reaksi negatif yang menunjukkan banyaknya kalor yang dilepas dari reaksi tersebut. Reaksi eksoterm juga dapat diketahui dengan melihat suhu reaksi tersebut, ketika suatu reaksi memiliki suhu akhir setelah reaksi yang meningkat atau naik berarti reaksi tersebut eksoterm karena sistem reaksi melepaskan panas yang kemudian diterima oleh lingkungan.
Contoh reaksi eksoterm yaitu membakar kertas, besi berkarat, mencampurkan asam dengan basa, membakar kayu, dan lain-lain.
-
Reaksi Endoterm
Reaksi endoterm adalah reaksi dimana pada reaksi ini akan menyerap suatu panas. Reaksi endoterm memiliki nilai entalpi reaksi atau positif yang berarti menyerap sejumlah panas dari lingkungan. Tanda bahwa suatu reaksi dikatakan endoterm yaitu pada suhu akhir setelah reaksi yang turun dari suhu awalnya.
Penurunan suhu dikarenakan sistem reaksi tersebut menyerap suhu dari lingkungan sekitarnya sehingga suhu lingkungan menjadi turun karena diserap. Contoh reaksi endoterm yaitu mencairnya es menjadi air, penguapan air, pelarutan urea di air, dan lain-lain.
Rumus Termokimia
Dikarenakan entalpi merupakan suatu fungsi keadaan, maka panas yang terlibat dalam suatu reaksi tidak tergantung pada arah reaksi tersebut apakah berlangsung dari reaktan ke produk atau sebaliknya dan namun tergantung dari tahap reaksi tersebut apakah satu langkah atau beberapa langkah reaksi.
Hukum Termokimia hess menyatakan bahwa jika dua reaksi digabungkan untuk menghasilkan reaksi ketiga, maka jumlah entalpi untuk dua reaksi pertama sama dengan entalpi reaksi ketiga.
Contoh entalpi reaksi dapat dilihat pada reaksi berikut:
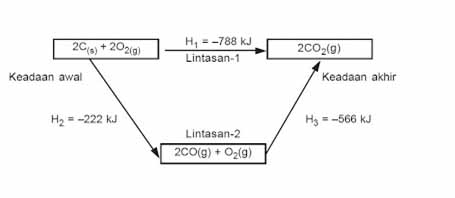
Dari reaksi tersebut dapat dilihat bahwa terdapat dua cara dalam reaksi yang membentuk CO. Reaksi pertama hanya melibatkan satu tahap saja, namun pada reaksi kedua terdapat dua tahapan untuk terjadinya produk. Berdasarkan diagram tingkat energinya, reaksi tersebut dapat digambarkan sebagai berikut:
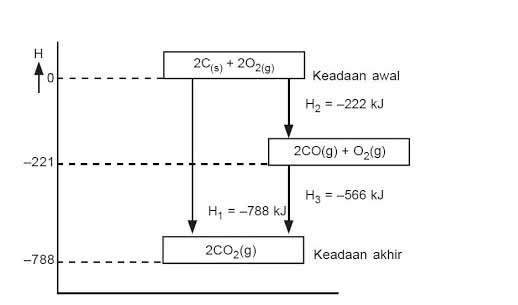
Dapat dilihat bahwa reaksi tersebut berlangsung eksoterm karena menghasilkan nilai entalpi yang negatif yang menandakan pelepasan panas. Keadaan awal reaktan dapat mengalami dua jenis reaksi yaitu langsung menjadi produk atau mengalami dua tahapan reaksi terlebih dahulu baru terbentuk produk.
Berdasarkan hukum Hess, ketika suatu reaksi terbentuk dari dua reaksi yang lain maka nilai entalpi reaksi total yang terbentuk adalah penjumlahan dari kedua reaksi tersebut. Hal itu ditemukan dalam reaksi yang berlangsung dua tahap dimana total entalpi dari kedua tahap reaksi tersebut ternyata sama dengan reaksi lain yang berlangsung satu tahap.
Reaksi satu tahap : CO (s) + O2 (g) → CO2 (g) ∆H = –394 kJ
Reaksi dua tahap : C (s) + ½ O2 (g) → CO (g) ∆H = –110 kJ
CO (g) + O2 (g) → CO2 (g) ∆H = –284 kJ
Total : C (s) + O2 (g) → CO2 (g) ∆H = –394 kJ
Contoh Termokimia
Sedangkan untuk contoh termokimia yang ada dalam kehidupan sehari-hari. Misalnya saja;
- Manusia juga menerapkan termokimia dalam tubuhnya yaitu sebagai contoh sel pada manusia yang melakukan reaksi pembakaran terhadap molekul organik seperti gula, lemak dan sumber makanan lain dengan kemudian menghasilkan panas dan energi yang berguna untuk melakukan aktivitas bagi manusia tersebut.
- Pada bidang industri, termokimia juga sangat penting untuk mendesain suatu reaksi yang efisien sehingga meningkatkan produktivitas industri tersebut.
Nah, itulah tadi serangkaian bahasan atas beragam materi tentang pengertian termokimia menurut para ahli, jenis sistem dalam kimia, objek kajian, macam reaksi, rumus, dan contohnya dalam kehidupan sehari-hari. Semoga melalui tulisan ini bisa memberikan wawasan serta refrensi mendalam bagi segenap pembaca sekalian.



