Asam basa bisa dikatakan sebagai bagian daripada istilah yang sering kita dengar apalagi bagi yang mempelajari tentang reaksi kimia tentu sudah tidak asing lagi dengan istilah tersebut. Selain dalam kimia, kita pun juga bisa menemukan asam basa dalam kehidupan sehari hari seperti asam dalam asam cuka lalu basa dalam sabun.
Hal yang kita tahu sederhana tersebut ternyata jika kita berbicara tentang teori menjadi tidak sederhana lagi. Beberapa ahli kimia telah mengemukakan pendapat mereka tentang teori asam basa yang tentunya didukung dengan fakta yang terjadi. Dalam mempelajari ilmu kimia, ada baiknya kita mengetahui macam teori asam basa kimia tersebut karena semua teori itu masih digunakan dan bermanfaat dalam kimia modern saat ini.
Asam Basa
Asam bukan hanya sesuatu yang jika kita makan akan menimbulkan rasa asam di lidah, namun asam dan basa ini merupakan sifat yang dimiliki oleh zat atau larutan. Sifat keasaman dan kebasaan ini sangat penting dalam kimia dimana hal itu akan menentukan karakteristik zat tersebut serta bagaimana reaksi yang mungkin terjadi pada zat tersebut.
Kita telah mengenal asam basa dalam parameter pH dimana dalam skala pH 1-14 tersebut kita dapat membedakan keasaman dan kebasaan suatu zat. Semakin rendah nilai pH suatu larutan maka dapat kita katakana bahwa senyawa tersebut bersifat asam.
Semakin tinggi nilai pH suatu larutan maka larutan tersebut basa. Jika nilai pH menunjukkan angka 7 maka larutan tersebut bersifat netral.
Teori Asam Basa
Adapun bahasan terkait teori asam basa ini dan cara menentukannya menurut para ahli, antara lain sebagai berikut;
-
Arrhenius
Menurut teori Arrhenius, asam merupakan suatu senyawa yang menyediakan arti ion hidrogen (H+) dalam larutan. Sedangkan basa merupakan senyawa yang menyediakan ion hidroksida (OH–) dalam larutan. Suatu reaksi penetralan dapat terjadi dengan adanya ion hidrogen dan ion hidroksida menghasilkan produk air.
H+ (aq) + OH– (aq) → H2O (l)
Kelemahan
Teori asam basa Arrhenius memiliki beberapa limitasi. Asam klorida (HCl) dapat dinetralkan oleh larutan natrium hidroksida ataupun larutan amonia. Dalam kedua kasus tersebut, kita akan mendapatkan larutan bening yang dapat dikristalisasi untuk menghasilkan garam putih baik itu garam natrium klorida atau garam amonium klorida.
NaOH + HCl → NaCl + H2O
NH3 + HCl → NH4Cl
Dalam kasus natrium hidroksida, ion hidrogen dari asam bereaksi dengan ion hidroksida dari natrium hidroksida dimana hal ini sejalan dengan teori Arrhenius. Sedangkan dalam kasus amonia, dalam reaksi tersebut tidak terdapat ion hidroksida. Namun ketika kita melihat reaksi tersebut, amonia akan bereaksi dengan air dengan reaksi sebagai berikut.
NH3 + H2O NH4+ + OH–
Reaksi tersebut bersifat reversibel atau dapat balik dan dalam reaksi tersebut terdapat ion hidroksida yang memungkinkannya untuk bereaksi dengan air sama seperti pada kasus natrium hidroksida.
Kita mungkin dapat membenarkan bahwa amonia bersifat sebagai basa berdasarkan definisi Arrhenius dimana dia mampu memproduksi ion hidroksida dalam larutan. Namun ternyata reaksi antar amonia dan HCl akan terjadi secara langsung antara molekul amonia dengan ion hidrogen sehingga hal ini tidak sesuai dengan teori Arrhenius.
Secara lebih jelas kita dapat melihat kasus ini dalam reaksi antara gas amonia dengan gas HCl. Reaksi ini tidak berlangsung dalam larutan sehingga tidak ada molekul H2O disana yang bereaksi dengan amonia membentuk ion hidroksida. Namun reaksi tersebut tetap akan menghasilkan NH4Cl sehingga hal ini tidak dapat didefinisikan sesuai teori Arrhenius.
-
Bronsted Lowry
Menurut teori asam basa Bronsed-Lowry, asam merupakan suatu proton donor atau menyerahkan ion hidrogen sedangkan basa merupakan proton akseptor atau menerima ion hidrogen.
Hubungan Teori Bronsted-Lowry dengan Arrhenius
Terdapat hubungan antara teori asam basa Bronsted-Lowry dengan teori asam basa Arrhenius. Dalam teori Bronsted-Lowry sebenarnya tidak berlawanan dengan teori Arrhenius dimana ion hidroksida tetap berperan sebagai basa. Namun dalam definisi Bronsted-Lowry, ion hidroksida tersebut akan menangkap ion hidrogen dari asam untuk membentuk air. Asam yang akan memberikan ion hidrogen ke dalam larutan untuk membentuk molekul air.
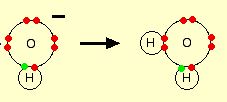
Ketika gas HCl terlarut dalam air untuk menghasilkan larutan HCl, molekul HCl tersebut akan memberikan proton (ion hidrogen) ke molekul air. Suatu ikatan kimia kovalen akan terbentuk antara pasangan elektron bebas dalam oksigen dengan hidrogen sehingga membentuk HCl. Dalam hal ini, ion hidronium (H3O+) akan diproduksi.
H2O + HCl → H3O+ + Cl–
Ketika asam bereaksi dengan basa, maka ion hidronium tersebut yang akan berfungsi sebagai asam. Sebagai contoh, suatu proton ditransfer dari ion hidronium ke ion hidroksida untuk membentuk dua molekul air.
H3O+ + OH– → 2 H2O
Masalah HCl/amonia
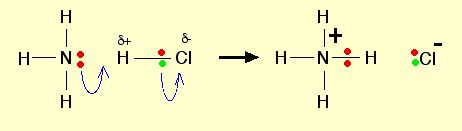
Kemudian kelemahan Arrhenius dalam kasus HCl/amonia dapat dijawab dalam teori Bronsted-Lowry. Dalam teori ini, dimana pun reaksi itu terjadi baik dalam bentuk larutan maupun dalam fasa gas, amonia tetap berperan sebagai basa sesuai definisi Bronsted-Lowry yang merupakan akseptor proton (ion hidrogen). Hidrogen akan terikat ke pasangan elektron bebas dari nitrogen dalam amonia melalui ikatan koordinasi.
Jika reaksi ini terjadi dalam larutan, maka amonia akan menangkap proton dari ion hidronium (H3O+).
NH3 (aq) + H3O+ (aq) → NH4+ (aq) + H2O (l)
Sedangkan jika reaksi terjadi dalam fasa gas, maka amonia akan menangkap proton secara langsung dari HCl.
NH3 (g) + HCl (g) → NH4+ (s) + Cl– (s)
Pasangan Konjugasi
Kita dapat melihat contoh pasangan konjugasi asam basa dalam reaksi antara amonia dengan air.
NH3 + H2O NH4+ + OH–
Dalam reaksi tersebut amonia (NH3) merupakan basa karena menyerap ion hidrogen dari ari. Sedangkan ion amonium (NH4+) merupakan asam konjugasinya dimana ion tersebut dapat melepaskan ion hidrogen untuk membentuk amonia dalam arah sebaliknya. NH3 dan NH4+ merupakan pasangan konjugasi.
Molekul air (H2O) berperan sebagai asam sedangkan basa konjugasinya adalah ion hidroksida (OH–). Ion hidroksida ini dapat menyerap hidrogen untuk membentuk air dalam arah reaksi sebaliknya. Pasangan antara air dan ion hidroksida adalah pasangan konjugasi lainnya.
Senyawa Amfoterik
Kita mungkin akan menyadari bahwa dalam contoh diatas, air dapat berperan sebagai asam maupun sebagai basa. Suatu senyawa yang bersifat demikian yakni dapat sebagai asam dan sebagai basa disebut sebagai senyawa amfoterik.
-
Lewis
Menurut teori Asam basa lewis merupakan teori yang paling umum dan banyak kita gunakan dalam mendefinisikan asam basa. Asam merupakan suatu akseptor pasangan elektron sedangkan basa merupakan suatu pasangan elektron donor.
Hubungan Teori Lewis dengan Bronsted-Lowry
Kita dapat melihat hubungan kedua teori ini dengan mudah dalam basa Bronsted-Lowry dimana dia mendefinisikan bahwa basa akan menangkap ion hidrogen. Alasan basa dapat bergabung dengan ion hidrogen adalah karena basa memiliki pasangan elektron bebas dimana hal ini dikatakan pada teori Lewis. Ion hidroksida memiliki pasangan elektron bebas yang akan digunakan untuk berikatan dengan ion hidrogen.
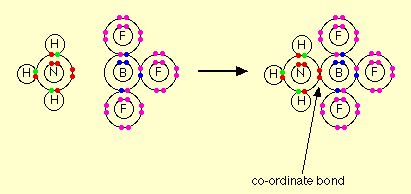
Sebagai contoh lain, dalam reaksi yang melibatkan amonia ataupun air mereka akan menggunakan pasangan elektron bebas yang dimilikinya untuk membentuk ikatan koordinasi dan membuat mereka berperan sebagai basa. Saat amonia bereaksi dengan senyawa BF3, amonia akan menggunakan pasangan elektron bebas yang dimiliki untuk membentuk ikatan koordinasi dengan orbital kosong dari boron.
Kemudian dalam definisi asam yang merupakan suatu akseptor pasangan elektron. Dalam contoh diatas, BF3 merupakan suatu asam Lewis dimana senyawa tersebut akan menerima donasi pasangan elektron dari atom nitrogen. Namun jika kita bandingkan dengan teori Bronsted-Lowry, BF3 tidak memiliki peran sebagai asam.
Selanjutnya contoh pada reaksi gas amonia dan gas HCl dimana terjadi penerimaan pasangan elektron bebas dari nitrogen. Suatu proton (H+) tidak memiliki elektron sehingga dia akan menerima elektron dari sesuatu yang memiliki pasangan elektron bebas yang tidak digunakan, dalam hal ini yaitu dari atom nitrogen.
Ikatan koordinasi akan terjadi antara nitrogen dan hidrogen dan hal itu diawali dengan pemecahan ikatan hidrogen dengan klorin yang menghasilkan ion klorida.
Nah, itulah tadi artikel yang memberikan penjelasan terkait dengan materi kimia. Khususnya mengulas tentang macam teori asam basa, cara menentukan, dan contohnya. Semoga melalui tulisan ini bisa memberikan wawasan serta menambah pengetahuan pembaca.