Tahukah kalian apa jenis ikatan kimia yang terjadi pada garam dan mengapa garam dapat larut dalam air? Semua itu dapat dijelaskan dalam teori ikatan ionik. Seperti yang kita ketahui bahwa ada beberapa arti ikatan kimia yang masing masing memiliki karakteristik yang unik. Sama halnya dengan ikatan ionik yang juga memiliki ciri dan karakteristik tersendiri.
Tetapi yang pasti, dalam menjelaskan ikatan ionik senantisa terbentuk ketika ada perbedaan elektronegativitas yang besar antara unsur-unsur yang berpartisipasi dalam ikatan. Artinya, semakin besar perbedaannya, semakin kuat tarikan antara ion positif (kation) dan ion negatif (anion). Salah satu sifat dari ikatan ionik yaitu merupakan ikatan yang terkuat dari semua ikatan.
Ikatan Ionik
Tentunya tidak semua atom dapat membentuk ikatan ionik dengan atom yang lain. Ada syarat tertentu yang harus dipenuhi suatu atom untuk membentuk suatu ikatan ionik. Jika suatu jenis atom tidak memenuhi persyaratan tersebut maka atom tersebut tidak dapat membentuk ikatan ionik dan mungkin dapat membentuk ikatan kovalen ataupun ikatan logam.
Dari segi sifat senyawa yang terbentuk maupun bagaimana proses terbentuknya ikatan ionik tentu akan berbeda jika dibandingkan ikatan kovalen maupun ikatan logam. Sesuatu yang terjadi pada garam merupakan salah satu contoh jenis ikatan ionik. Dalam hal ini garam seperti natrium klorida ataupun kalium klorida juga termasuk dalam senyawa ionik.
Pengertian Ikatan Ionik
Definisi ikatan ionik adalah salah satu jenis ikatan kimia yang terbentuk oleh adanya tarikan elektrostatik antara dua atom dengan muatan yang berbeda. Seperti yang kita tahu bahwa pada keadaan normal, atom memiliki muatan netral. Namun beberapa jenis atom memiliki kemampuan untuk melepaskan elektron atau menangkap elektron lain.
Atom yang melepaskan elektron akan menjadi bermuatan positif atau disebut sebagai kation. Sedangkan atom yang menangkap elektron akan menjadi bermuatan negatif dan disebut sebagai anion. Kedua atom bermuatan ini dapat saling tarik menarik karena adanya muatan yang berbeda pada kedua atom tersebut. Ketika tarik menarik mendekatkan kedua atom dan menghubungkan kedua atom, maka ikatan yang terjadi antara atom tersebut adalah ikatan ionik.
Pengertian Ikatan Ionik Menurut Para Ahli
Adapun definisi ikatan ionik menurut para ahli, antara lain;
- James E. Brady (1990), Ikatan ionik adalah sebagai ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain.
- Encyclopedia Britannica, Pengertian ikatan ionik adalah jenis ikatan yang terbentuk dari tarikan elektrostatis antara ion-ion yang bermuatan berlawanan dalam suatu senyawa kimia. Ikatan seperti itu terbentuk ketika elektron valensi (terluar) dari satu atom dipindahkan secara permanen ke atom lain. Atom yang kehilangan elektron menjadi ion bermuatan positif (kation), sedangkan yang memperoleh elektron menjadi ion bermuatan negatif (anion).
Ciri Ikatan Ionik
Adapun karakteristik ikalatan ionik, antara lain;
- Suatu ikatan ionik terbentuk melalui transfer penuh elektron valensi dari satu atom ke atom lain untuk mencapai suatu kestabilan.
- Jenis ikatan ini memungkinkan terbentuknya dua muatan ion yang berlawanan yakni ion bermuatan positif atau kation dan ion bermuatan negatif atau anion.
- Keberadaan dua ion dengan muatan yang berlawanan ini akan menghasilkan gaya tarikan yang kuat antara keduanya.
- Ikatan ionik terjadi antara atom non logam dengan atom logam alkali atau alkali tanah
- Ikatan ionik terbentuk dari atom yang memiliki perbedaan elektronegativitas yang besar bahkan lebih besar daripada ikatan kovalen polar
- Senyawa yang terbentuk dengan adanya gaya tarik elektrostatik antara ion positif dan ion negatif disebut dengan senyawa ionik
Sifat Ikatan Ionik
Sedangkan terdapat macam-macam sifat yang ada dalam ikatan ionik, antara lain;
-
Membentuk kristal
Keistimewaan sebuah senyawa ionik adalah senyawa tersebut berada dalam bentuk kristal. Pada tingkat atomik, suatu anion dan kation akan saling bergabung untuk membentuk susunan struktur kristal tiga dimensi berdasarkan ukuran dari ion yang terlibat didalamnya.
Suatu kristal memiliki struktur yang rapi dan berulang. Sebagai contoh dalam garam dapur (NaCl) memiliki struktur kristal kubus dimana ion Na+ dan Cl– akan membentuk susunan kubus secara berulang dan tentunya tiga dimensi.
-
Titik didih dan titik leleh yang tinggi
Energi yang lebih besar diperlukan untuk memecah ikatan ionik yang terjadi antara ion positif dan ion negatif dalam senyawa ionik. Oleh karena itu, titik didih dan titik leleh dari suatu senyawa ionik pun akan lebih tinggi dan umumnya lebih tinggi dari senyawa kovalen.
Titik didih yang tinggi juga membuat senyawa ionik tidak mudah menguap sehingga pada umumnya senyawa ionik tidak memiliki bau yang menyengat karena tidak ada zat yang berbentuk gas dan dapat dihirup oleh indra penciuman.
-
Entalpi peleburan dan penguapan yang tinggi
Sesuai dengan sifatnya yang memiliki titik didih dan titik leleh tinggi, senyawa ionik juga memiliki kalor entalpi peleburan dan penguapan yang 10 hingga 100 kali lebih tinggi dibandingkan suatu senyawa molekular.
Entalpi peleburan merupakan panas yang dibutuhkan untuk melelehkan satu mol padatan dalam tekanan konstan. Sedangkan entalpi penguapan adalah panas yang dibutuhkan untuk menguapkan satu mol senyawa dalam bentuk cairan pada tekanan tetap.
-
Keras namun rapuh
Kekerasan yang tinggi pada senyawa ionik akibat adanya tarikan yang sangat kuat antara ion positif dan ion negatif dalam senyawa ionik sehingga membuat satu dengan yang lain sulit untuk dipisahkan.
Namun, adanya tekanan dapat menginduksi gaya elektrostatik di dalamnya untuk memecahkan kristal tersebut. Ketika suatu struktur telah mengalami split maka sangat mudah bagi senyawa ionik tersebut untuk pecah. Oleh karena itu suat senyawa ionik memiliki struktur yang keras namun rapuh.
-
Larut dalam air
Senyawa ionik merupakan senyawa yang mudah larut dalam air. Air merupakan sebuah senyawa yang bersifat sangat polar dimana struktur air memiliki muatan dipol positif pada atom hidrogen dan dipol negatif pada oksigen yang disebabkan karena tarikan elektron oleh atom oksigen dimana atom ini memiliki nilai elektronegativitas yang tinggi.
Adanya muatan dipol dalam air maka suatu senyawa ionik akan terdisosiasi dalam air menjadi ion penyusunnya dan masing masing ion tersebut akan tertarik pada muatan dipol air yang berlawanan. Hal ini menjelaskan pernyataan di awal mengapa garam dapat larut dalam air dimana ion Na+ akan tertarik ke arah atom oksigen dari air sedangkan ion Cl– akan tertarik ke arah hidrogen dari molekul air.
-
Larutan dan lelehan dapat menghantarkan listrik
Dalam air, senyawa ionik akan terdisosiasi sebagai anion dan kation. Adanya anion dan kation memungkinkannya untuk menjadi konduktor listrik dimana masing masing ion tersebut yang akan bergerak dalam larutan untuk mengalirkan listrik. Selain larutannya, lelehan dari senyawa ionik juga dapat menjadi penghantar listrik.
-
Isolator yang baik
Meskipun dalam bentuk larutan dan lelehannya dapat menghantarkan listrik, namun padatan senyawa ionik tidak dapat menghantarkan listrik atau bersifat isolator. Hal itu karena setiap ion terikat begitu erat dengan ion yang lain sehingga tidak memungkinkan terjadinya pergerakan elektron untuk menghantarkan listrik.
Contoh Senyawa Ionik
Contoh senyawa ionik yang paling familiar, antara lain seperti;
-
Garam Dapur
Garam dapur yang dapat kita temukan dengan mudah di dapur. Garam dapur atau natrium klorida memiliki rumus kimia NaCl dan memiliki titik didih yang tinggi yakni 800 oC.
Kita dapat mengetahui sifat senyawa ionik dalam garam dapur dengan melarutkan senyawa ini dalam air dan kemudian dilakukan uji untuk menghantarkan listrik maka larutan tersebut akan mampu menghantarkan listrik dengan baik.
Jika kita melihat struktur garam dapur secara mikroskopis, maka kita dapat melihat bagaimana struktur kubik yang teratur dalam garam dapur yang dihasilkan dari kisi kristal.
Meskipun kita dapat mengetahui rasa garam dengan mudah yakni memiliki rasa asin, namun kita akan sulit mengidentifikasi garam dengan penciuman karena tekanan uap yang sangat rendah dimiliki garam dapur sehingga akan sangat sulit untuk mencapai indra penciuman manusia.
-
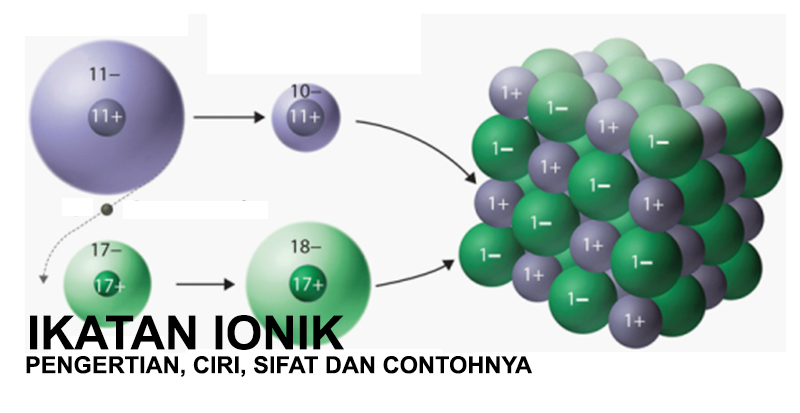
Natrium (Na): 2,8,1 dan Klor (Cl): 2, 8, 7
Contoh paling umum dari ikatan ionik adalah pembentukan natrium klorida di mana atom natrium bergabung dengan atom klor. Mari kita lihat konfigurasi elektronik masing-masing unsur:
Jadi, kita melihat bahwa atom klor hanya membutuhkan satu elektron untuk mencapai konfigurasi gas mulia terdekat, yaitu Argon (2,8,8). Sebaliknya, atom natrium perlu membuang satu elektron di kulit terluarnya untuk mendapatkan konfigurasi gas mulia terdekat, yaitu Neon (2,8).
Dalam contoh kasus tersebut, atom natrium menyumbangkan elektron terluarnya pada atom klor, yang hanya memerlukan satu elektron untuk dapat mencapai konfigurasi oktet. Ion natrium menjadi bermuatan positif karena hilangnya elektron, sedangkan ion klorida menjadi bermuatan negatif karena mendapatkan elektron tambahan. Ion bermuatan berlawanan, yang terbentuk, tertarik satu sama lain dan menghasilkan pembentukan ikatan ionik.
Contoh lain senyawa ionik selain NaCl yaitu;
- KCl, Mg(OH)2
- LiF, NaF
- Dan lain lain
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa senyawa ionik merupakan senyawa yang terbentuk melalui adanya ikatan ionik di dalamnya. Ikatan ionik dapat terbentuk antara atom non logam dengan atom logam alkali atau alkali tanah. Dalam suatu kristalin ionik, gaya tarik menarik elektrostatik antara ion positif dan ion negatif membuat sebuah molekul menjadi kuat.
Dalam hal ini kedua ciri ion bermuatan tersebut bersifat saling menyeimbangkan atau saling menetralkan sehingga didapatkan senyawa yang tak bermuatan dan hal itu akan meningkatkan stabilitas senyawa. Gaya tarik menarik dalam kristalin tersebut tentunya dapat ditentukan secara pasti melalui perhitungan tertentu.
Jika kita mengulas kembali ikatan kovalen, ikatan ionik ini hampir sama seperti sebuah ikatan kovalen polar namun sangat ekstrem. Jika dalam ikatan kovalen terbentuk dari dua atom yang berbeda keelektronegatifan maka dalam ikatan ionik ini yang berbeda adalah sudah lebih tinggi dari elektronegativitas yakni muatannya.
Elektron dalam ikatan kovalen tidak dipindahkan secara penuh oleh satu atom ke atom lain melainkan digunakan secara bersama sama oleh kedua atom. Namun dalam ikatan ionik elektron diberikan secara penuh dari satu atom ke atom lain sehingga akan mempengaruhi muatan atom atom tersebut.
Itulah tadi uraian lengkap yang bisa kami lakukan kajian terkait dengan pengertian ikatan ionik menurut para ahli, ciri, sifat, dan contohnya yang mudah ditemukan. Semoga bisa memberi edukasi serta referensi bagi segenap pembaca yang memperlukannya.


