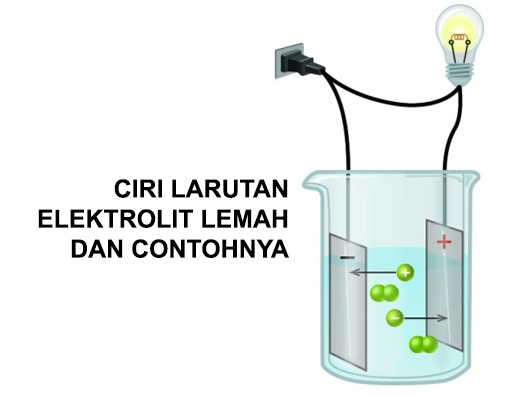
Larutan merupakan suatu zat yang terdiri dari pelarut dan mengandung zat terlarut. Suatu larutan elektrolit memiliki kandungan untuk arti ion bebas di dalamnya. Suatu larutan elektrolit memiliki kemampuan untuk menghantarkan listrik.
Baik itu laruran elektrolit kuat maupun elektrolit lemah keduanya mampu berperan sebagai penghantar listrik. Namun dalam kedua jenis larutan elektrolit tersebut tentu akan memiliki perbedaan karakteristik dalam perannya sebagai penghantar listrik.
Larutan Elektrolit
Larutan elektrolit merupakan suatu larutan yang memiliki kandungan ion ion bermuatan didalamnya sehingga larutan tersebut memungkinkan untuk menjadi penghantar listrik. Seperti yang kita ketahui bahwa listrik dapat mengalir jika dalam suatu sistem terjadi pergerakan elektron.
Dalam hal ini, larutan elektrolit mengandung ion ion yang memungkinkan untuk terjadinya transfer elektron dalam larutan tersebut. Kemampuan ini mendukung konduktivitas listrik dari larutan tersebut.
Karena larutan elektrolit mengandung ion ion didalamnya, maka larutan ini juga dikenal sebagai larutan ionik. Ion merupakan suatu atom yang kehilangan elektron ataupun menerima donor elektron sehingga akan menyebabkan atom tersebut menjadi bermuatan.
Ketika suatu teori atom kehilangan elektron maka akan menyebabkannya bermuatan positif atau disebut dengan kation. Sedangkan ketika atom tersebut menerima elektron dalam jumlah tertentu maka atom tersebut akan bermuatan negatif atau disebut dengan anion.
Keberadaan ion dalam suatu larutan elektrolit terjadi karena adanya proses ionisasi atau disosiasi suatu senyawa dalam pelarut tertentu. Ketika suatu zat dilarutkan dengan pelarut, maka proses pelarutan zat tersebut akan terjadi dengan pemecahan struktur senyawa tersebut menjadi zat yang lebih kecil dalam bentuk ion ion penyusunnya.
Larutan Elektrolit Lemah
Larutan elektrolit lemah yaitu suatu larutan yang terbentuk dari zat yang tidak terdisosiasi secara sempurna dalam pelarut. Dapat pula dikatakan bahwa dalam larutan elektrolit lemah, suatu zat hanya terdisosiasi sebagian.
Proses disosiasi atau ionisasi yang memecah suatu zat menjadi ion ionnya tidak terjadi pada semua zat yang ada dalam sistem tersebut melainkan masih menyisakan bagian senyawa tersebut secara utuh. Oleh karena itu pada larutan elektrolit lemah masih akan ditemukan senyawa awal dari zat tersebut.
Seberapa besar zat tersebut akan terionisasi dalam larutan akan ditentukan oleh nilai derajat ionisasinya. Jika kita mengenal dalam larutan elektrolit kuat memiliki derajat ionisasi sama dengan satu yang disebabkan karena proses ionisasi terjadi secara sempurna, maka dalam senyawa elektrolit lemah ini memiliki nilai derajat ionisasi dibawah satu.
Semakin kecil nilai derajat ionisasi maka semakin kecil jumlah zat yang terpecah menjadi ion ion dalam larutan dan semakin lemah larutan elektrolit tersebut.
Seperti yang kita ketahui bahwa suatu listrik dapat mengalir dalam larutan melalui perantara ion ion yang terkandung dalam larutan. Adanya ion ion dalam larutan memungkinkan terjadinya transfer elektron dari satu elektroda ke elektroda lain melalui reaksi reduksi oksidasi atau reaksi redoks didalam prosesnya.
Ketika jumlah ion yang berada dalam larutan itu banyak dan tidak ada zat lain didalamnya, maka pergerakan ion dalam suatu larutan untuk membawa elektron dari tiap elektroda akan terjadi secara cepat dan dalam jumlah yang banyak.
Hal itulah yang terjadi dalam larutan elektrolit kuat. Namun dalam larutan elektrolit lemah tidak terjadi demikian karena tidak semua zat terionisasi secara sempurna maka jumlah ion dalam larutan relatif lebih sedikit dan dalam larutan juga masih terdapat senyawa yang tidak terionisasi. Hal tersebut tentu akan menghalangi pergerakan ion ion dalam larutan untuk menghantarkan elektron antar elektroda.
Ciri Larutan Elektrolit Lemah
Setelah kita mengetahui bagaimana suatu larutan elektrolit lemah itu terbentuk. Tentu kita memahami perbedaan antara larutan elektrolit kuat dengan larutan elektrolit lemah. Perbedaan itu ternyata juga akan mempengaruhi ciri ciri larutan elektrolit lemah.
Berikut ini beberapa ciri dan karakteristik larutan elektrolit lemah. Antara lain;
-
Kurang Baik dalam Menghantarkan Listrik
Tentunya larutan elektrolit lemah masih dapat berperan sebagai penghantar energi listrik, namun yang membedakan dengan larutan elektrolit kuat yakni daya hantar dari larutan elektrolit lemah kurang baik. Dapat dikatakan bahwa larutan elektrolit lemah memiliki nilai konduktivitas elektrik yang rendah.
Hal ini disebabkan karena faktor kandungan jumlah ion yang relatif lebih sedikit dalam suatu larutan dan juga keberadaan senyawa yang tidak terionisasi akan menghalangi pergerakan ion ion dalam larutan ini.
Kita dapat melakukan uji konduktivitas listrik dalam larutan elektrolit lemah dengan menggunakan alat penguji daya hantar listrik. Cara lain yang lebih mudah adalah dengan menggunakan uji baterai dan lampu.
-
Dapat Menghasilkan Nyala Lampu yang Redup
Seperti yang telah disinggung sebelumnya bahwa cara mudah untuk menguji daya hantar larutan elektrolit adalah melalui eksperimen.
Pengujian dapat dilakukan dengan menghubungkan kutub baterai ke elektroda semisal tembaga yang dicelupkan ke dalam larutan elektrolit uji. Kemudian pada bagian lain larutan tersebut dicelupkan pula elektroda tembaga lain yang terhubung dengan lampu dan terhubung kembali ke kutub baterai yang lain.
Larutan elektrolit lemah tetap akan menghasilkan nyala lampu namun relatif lebih redup jika dibandingkan dengan larutan elektrolit kuat.
Namun jika ingin membandingkan dengan larutan elektrolit lain, pastikan bahwa daya baterai yang digunakan sama sehingga hasilnya akan lebih tepat. Nyala redup ini tentu mengindikasikan bahwa kemampuan daya hantar listrik dari larutan elektrolit lemah ini rendah.
Dalam beberapa kasus, ada beberapa jenis larutan elektrolit lemah yang tidak mampu menyalakan lampu uji. Namun jika kita mendapatkan hasil demikian, maka kita harus melihat ke ciri selanjutnya yang mengindikasikan larutan elektrolit lemah.
-
Menghasilkan Sedikit Gelembung Gas
Berhubungan dengan uji eksperimen yang ada pada point sebelumnya, ketika dilakukan uji baterai dan lampu maka larutan elektrolit lemah akan menghasilkan gelembung gas.
Ketika suatu larutan elektrolit lemah tidak mampu membuat lampu menyala, kita dapat melihat ciri ini bahwa larutan elektrolit lemah tetap akan menghasilkan gelembung gas dengan jumlah sedikit didalamnya. Maka dari itu kita dapat menyimpulkan bahwa larutan tersebut bersifat elektrolit lemah meskipun tidak mampu menyalakan lampu.
Hal ini bisa terjadi dalam larutan elektrolit lemah karena gelembung gas itu terbentuk karena adanya reaksi redoks yang melepaskan gas seperti gas hidrogen. Tentu saja reaksi ini dapat diketahui dengan adanya produk gelembung gas yang terbentuk.
Namun dalam larutan elektrolit lemah, terkadang jumlah ion yang ada dalam larutan sangat sedikit sehingga hanya mampu menghasilkan gelembung gas namun tetap tidak mampu menyalakan listrik karena kurangnya elektron yang bergerak dari satu elektroda ke elektroda lain. Oleh karena itu, terbentuknya gelembung gas saja sudah cukup untuk mengindikasikan larutan elektrolit lemah.
-
Zat Terdisosiasi Sebagian
Seperti yang telah dijelaskan sebelumnya bahwa dalam larutan elektrolit, suatu senyawa tidak akan berubah menjadi ion secara sepenuhnya. Hanya sebagian saja yang mengalami reaksi ionisasi atau disosiasi dalam pelarut.
-
Derajat Ionisasi Lebih dari 0 Namun Kurang dari 1
Suatu larutan elektrolit lemah memiliki derajat ionisasi yang lebih dari 0 dan kurang dari 1. Derajat ionisasi 0 dimiliki oleh larutan non elektrolit sedangkan derajat ionisasi 1 dimiliki oleh larutan elektrolit kuat.
Dalam hal ini, jika derajat ionisasi suatu senyawa mendekati 1 maka senyawa tersebut akan memiliki kekuatan sifat elektrolit yang lebih tinggi. Sedangkan jika nilai derajat ionisasi senyawa itu mendekati 0 maka sifat larutan elektrolit dari senyawa tersebut juga semakin lemah
Contoh Larutan Elektrolit Lemah
Suatu larutan elektrolit lemah dapat berasal dari senyawa asam lemah dan juga basa lemah. Sedangkan garam umumnya tidak membentuk larutan elektrolit lemah melainkan larutan elektrolit kuat. Berikut ini adalah beberapa contoh larutan elektrolit lemah dan juga reaksi disosiasinya.
Asam Lemah
CH3COOH : CH3COOH (aq) ⇄ CH3COO– (aq) + H+ (aq)
H2CO3 : H2CO3 (aq) ⇄ HCO3– (aq) + H+ (aq)
H3PO4 : H3PO4 (aq) ⇄ H2PO4– (aq) + H+ (aq)
Basa Lemah
NH3 : NH3 (aq) + H2O (l) ⇄ NH4+ (aq) + OH– (aq)
C5H5N : C5H5N (aq) + H2O (l) ⇄ C5NH6+ (aq) + OH– (aq)
Demikian artikel tentang pembahasan ciri ciri larutan elektrolit lemah dan contohnya. Masih banyak contoh dari larutan elektrolit lemah yang ada sesuai dengan sifatnya yakni asam lemah dan basa lemah. Semoga artikel ini dapat bermanfaat bagi semuanya.