Bilangan kuantum bisa dikatakan sebagai suatu nilai yang dapat digunakan untuk menggambarkan lintasan serta pergerakan elektron dalam suatu jenis partikel atom. Oleh karena itulah, maka bilangan kuantum juga dapat mewakili tingkat energi yang tersedia dalam suatu atom ataupun molekul.
Disisi lainnya, terdapat empat jenis bilangan kuantum yang dapat menggambarkan keadaan dan posisi suatu elektron dalam atom. Penjelasan ini terdapat dalam teori kuantum yang menjadi penyempurnaan dari teori atom yang telah dicetuskan sebelumnya yang tidak dapat menjelaskan fenomena tertentu yang terjadi pada elektron. Oleh karena itu, untuk mempelajari kimia modern maka kita perlu mengetahui tentang perkembangan teori atom terbaru yaitu dengan mempelajari teori kuantum.
Bilangan Kuantum
Teori mengenai kuantum ini dalam penerapan kimia telah mengalami perkembangan sesuai dari perkembangan teori atom. Teori kuantum merupakan teori yang terbaru dan memiliki tingkat kerumitan yang paling tinggi dengan berbagai perhitungan kompleksnya yang dinamakan persamaan Schrodinger yang merupakan pengembang teori ini. Jika dibandingkan dengan teori atom yang lama, teori kuantum ini dapat menjelaskan secara lebih detail dan spesifik tentang posisi dan keadaan suatu elektron dalam satu atom tertentu.
Teori kuantum ini sangat berhubungan erat dengan konfigurasi elektron serta orbital. Orbital merupakan suatu fungsi yang dapat menggambarkan perilaku elektron dalam atom. Pada umumnya, orbital ini menjadi lintasan tempat bergeraknya elektron.
Pengertian Bilangan Kuantum
Bilangan kuantum adalah nilai yang mewakili posisi elektron dalam suatu atom secara spesifik. Seperti yang telah dipelajari pada materi konfigurasi elektron dimana setiap atom memiliki jumlah elektron tertentu yang tersusun dengan tingkat energi yang tertentu pula mengikuti orbitalnya. Semua elektron tersebut bergerak secara acak pada tingkat energinya sehingga karena pergerakannya yang acak tersebut akan sulit menentukan dimana posisi elektron pada waktu tertentu.
Dengan adanya bilangan kuantum yang terdiri dari empat jenis, posisi elektron dapat diwakilkan melalui bilangan kuantum tersebut sehingga kita dapat mengetahui posisi elektron saat waktu tertentu. Dalam satu atom, tidak terdapat elektron yang memiliki keempat bilangan kuantum yang sama. Artinya bahwa keberadaan elektron tersebut dapat secara spesifik ditentukan melalui bilangan kuantum yang ada.
Jika kita berbicara mengenai tingkat energi, maka pada teori atom sebelumnya seperti yang telah dikemukakan oleh Bohr dan de Broglie yang menetapkan bahwa elektron memang memiliki tingkat energi diskrit yang berbeda dan tergantung dari jari jari atom. Pada teorinya, posisi elektron digambarkan seperti pada bola yang relatif sederhana.
Teori ini telah mengungkapkan adanya tingkat energi elektron yang terkait dengan bilangan kuantum utama (n), namun pada teori ini tidak mampu menjelaskan secara spesifik tentang gerakan elektron yang terjadi seperti orientasinya ataupun arah geraknya.
Schrodinger menyempurnakan teori tersebut dengan teori kuantumnya dimana dia menambahkan 3 bilangan kuantum yang dapat digunakan untuk menggambarkan perilaku elektron bahkan tidak hanya dalam hidrogen yang hanya memiliki satu elektron saja, melainkan juga dalam atom yang memiliki banyak elektron.
Macam Bilangan Kuantum
Adapun untuk beragam jenis bilangan kuantum dalam ilmu kimia, antara lain sebagai berikut;
-
Bilangan Kuantum Utama (n)
Bilangan kuantum utama dilambangkan dengan huruf n yang menunjukkan kulit elektron utama dalam suatu atom. Bilangan kuantum utama ini dapat menjelaskan jarak yang paling mungkin terjadi antara inti dengan elektron.
Nilai bilangan kuantum utama yang semakin besar menunjukkan bahwa jarak antara elektron dan inti besar sehingga dapat dikatakan bahwa ukuran atomnya pun besar, dan sebaliknya ketika nilainya kecil maka jarak elektron dengan inti pun kecil dan ukuran atom relatif lebih kecil.
Nilai bilangan kuantum utama berupa bilangan bulat positif yang dimulai dari angka 1. Angka tersebut menunjukkan juga tingkat energi yang ditempati oleh satu elektron.
Ketika elektron mengalami eksitasi, maka elektron akan berpindah dari satu orbital ke orbital yang lebih tinggi dan menyebabkan kenaikan nilai bilangan kuantum utama. Demikian pula ketika elektron kehilangan energi maka akan berpindah ke orbital yang lebih rendah tingkat energinya dengan diikuti penurunan nilai bilangan kuantum utama.
-
Bilangan Kuantum Azimuth (l)
Bilangan kuantum azimuth atau juga dapat dikatakan sebagai kuantum momentum sudut merupakan bilangan kuantum yang menggambarkan bentuk orbital yang ditempati elektron. Nilai bilangan kuantum azimuth sama dengan jumlah total sudut dalam orbital. Bilangan ini digambarkan dalam nilai berkisar antara 0 hingga n-1 dimana n adalah bilangan kuantum utama.
Bilangan kuantum azimuth dapat menunjukkan subkulit s, p, d, atau f yang ditempati oleh elektron. Sebagai contoh yaitu ketika nilai bilangan kuantum utama n = 3, maka nilai yang mungkin dari bilangan kuantum azimuth l = 0, 1, dan 2. Jika secara spesifik diketahui nilai l = 1 maka terdapat 1 sudut pada orbital dimana itu dimiliki oleh orbital p.
-
Bilangan Kuantum Magnetik (ml)
Bilangan kuantum magnetik memiliki nilai yang bergantung dari bilangan kuantum azimuth. Untuk nilai kuantum azimuth l yang diberikan maka bilangan kuantum magnetik memiliki rentang nilai antara interval -l hingga +l. Oleh karena itu bilangan ini tidak secara langsung tergantung pada nilai kuantum utama melainkan azimuth.
Sebagai contoh ketika diketahui suatu elektron memiliki n = 3, dan l = 2 dalam sebuah atom. Maka, nilai kuantum magnetik yang mungkin adalah -2, -1, 0, +1, +2. Bilangan kuantum magnetik ini memberikan gambaran tentang tingkat energi yang tersedia dalam satu subkulit dan menghasilkan proyeksi momentum sudut orbital pada sumbu tertentu.
-
Bilangan Kuantum Spin (ms)
Bilangan kuantum spin merupakan satu satunya bilangan kuantum yang tidak tergantung dari ketiga bilangan kuantum yang lain. Nilai kuantum spin memberikan penjelasan mengenai arah perputaran elektron dan dituliskan dengan simbol ms. Nilai bilangan kuantum spin dapat ditulis sebagai -1/2 atau +1/2 yang menggambarkan kuantum arah perputaran satu elektron.
Nilai positif menunjukkan bahwa putaran elektron ke arah atas dan dapat juga dituliskan dengan anak panah ke atas, sedangkan nilai negatif menunjukkan putaran elektron ke arah bawah yang dapat juga dituliskan dengan anak panah ke bawah.
Ketika ketiga bilangan kuantum (utama, azimuth, dan magnetik) suatu elektron sama, maka dapat dipastikan bahwa elektron tersebut memiliki bilangan kuantum spin yang berbeda karena dalam satu atum, tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama.
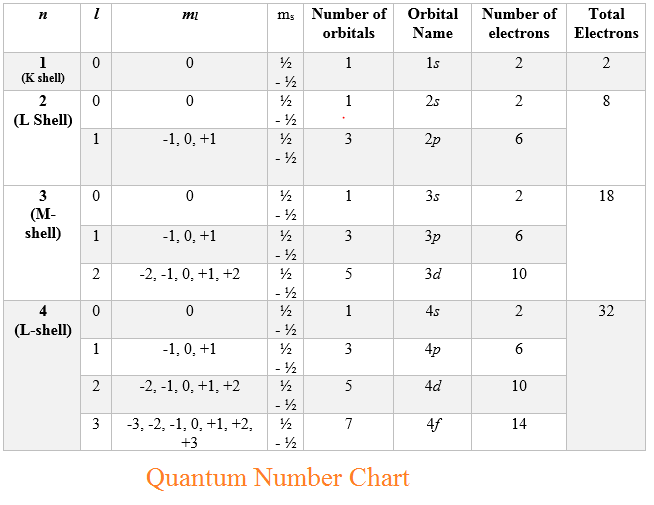
Untuk menentukan bilangan kuantum dapat dibantu menggunakan tabel bilangan kuantum dimana pada tabel tersebut terdapat nilai yang mungkin untuk bilangan kuantum dari satu elektron. Pada penentuannya, kembali lagi pada konfigurasi elektron dari atom tersebut.
Dengan melihat tabel maka kita dapat melakukan korelasi antara bilangan kuantum dengan jenis subkulit yang ditempati, jumlah subkulit, jumlah orbital, serta jumlah elektron maksimum yang dapat menempati orbital tersebut. Begitu pula sebaliknya, ketika diketahui posisi elektron pada subkulit jenis apa dengan tingkat energinya, maka kita dapat menentukan bilangan kuantum dari elektron tersebut.
Jika kita dapat mengetahui semua bilangan kuantum tersebut, maka kita dapat menentukan secara pasti dimana posisi suatu elektron dalam atom itu berada. Ketika kita sudah mengetahui posisi elektron maka dapat ditentukan tingkat energi, bentuk orbital, jenis orbital, dan juga arah putaran elektronnya.
Hal itu penting untuk diketahui karena posisi suatu elektron dalam orbital akan berpengaruh dalam terjadinya ikatan kimia.
Contoh Soal Bilangan Kuantum dan Jawabannya
Untuk memperjelas atas materi diatas, berikut ini adalah contoh dengan bialngan kuantum. Antara lain;
- Jika suatu elektron dalam atom memiliki bilangan kuantum utama n = 4, maka tentukan bilangan kuantum azimuthnya!
- Bilangan kuantum utama n = 4
- Bilangan kuantum azimuth l = n-1 = 4-1 = 3 maka l = 0, 1, 2, 3
- Tentukan bilangan kuantum magnetik dari elektron yang memiliki bilangan kuantum azimuth 4!
- Bilangan kuantum azimuth l = 4
- Maka bilangan kuantum magnetik ms = -4, -3, -2, -1, 0, +1, +2, +3, +4
- Jika suatu elektron menempati tingkat energi 4d, tentukan bilangan kuantum utama, bilangan kuantum azimuth, dan bilangan kuantum magnetiknya!
- Elektron terletak pada 4d, maka nilai n = 4
- Pada 4d, subkulit d menunjukkan bahwa bilangan kuantum azimuth l = 2 (lihat tabel)
- Pada l = 2, maka ms = -2, -1, 0, +1, +2
Nah, itulah tadi materi yang dapat kami tuliskan serta bagikan kepada segenap pembaca terkait dengan pengertian bilangan kuantum, macam, pembahasan, contoh soal dan jawabannya. Semoga melalui artikel ini memberikan pemahaman.



