
Hidrolisis pada hakekatnya adalah salah satu arti reaksi kimia sederhana yang paling sering terjadi dalam kehidupan kita. Reaksi hidrolisis ini merupakan reaksi yang melibatkan molekul air dalam pemecahan senyawa. Pada manusia proses hidrolisis terjadi dalam proses pencernaan makanan, dimana makanan yang telah masuk ke sistem pencernaan akan dicerna oleh organ namun akan diawali dengan hidrolisis dengan molekul air dalam tubuh.
Adapun dalam penerapan kimia, sangat banyak proses kimiawi yang terjadi dengan reaksi hidrolisis, lantaran hidrolisis banyak digunakan dalam industri untuk melakukan pemecahan suatu struktur kimia tertentu menjadi fraksi atau part yang lebih sederhana. Pada umumnya, senyawa kimia organik telah memiliki jalur atau pathway masing-masing yang berbeda untuk tiap senyawa dalam mengalami proses hidrolisis menggunakan air.
Hidrolisis
Hidrolisis adalah sitilah bahwa yang berasal dari bahasa Yunani Kuno “hidro” yang berarti ‘air’, dan lisis, yang berarti ‘tidak mengikat’.
Makna ini mengindikasikan bahwa setiap reaksi kimia di mana molekul air memecah satu atau lebih ikatan kimia. Adapun untuk istilah ini digunakan secara luas untuk reaksi substitusi, eliminasi, dan solvasi di mana air adalah nukleofil.
Pengertian Reaksi Hidrolisis
Pengertian hidrolisis adalah salah satu jenis reaksi dekomposisi suatu zat dengan menggunakan air sebagai media untuk memecah ikatan zat tersebut. Dalam bahasa Yunani, hidrolisis berasal dari kata hidro yang berarti air dan lisis yang berarti “memecah ikatan”. Sehingga dapat diartikan hidrolisis merupakan tindakan untuk memecah beragam macam bahan kimia dengan menggunakan air.
Hidrolisis dapat didefinisikan sebagai kebalikan dari reaksi sintesis kondensasi yang merupakan proses dimana dua molekul saling bergabung membentuk sebuah molekul yang lebih kompleks dengan melepaskan air. Untuk membedakannya sangat mudah, reaksi hidrolisis membutuhkan air sedangkan reaksi kondensasi menghasilkan air. Air atau H2O akan mengalami fragmentasi menjadi ion hidrogen (H+) dan ion hidroksida (OH–) yang akan berperan dalam reaksi hidrolisis ini.
Pengertian Hidrolisis Menurut Para Ahli
Adapun definisi hidrolisis menurut para ahli, antara lain:
- Biology LibreTexts, Hidrolisis adalah reaksi yang menghasilkan pemecahan polimer menjadi monomer dengan menggunakan molekul air dan katalis enzimatik. Air digunakan dalam reaksi hidrolisis untuk memecah polimer menjadi monomer dan merupakan kebalikan dari proses sintesis dehidrasi, yang membentuk air saat mensintesis polimer dari monomer.
- Encyclopedia Britannica, Arti hidrolisis, dalam kimia dan fisiologi, merupakan reaksi dekomposisi ganda dengan air sebagai salah satu reaktan.
Macam Hidrolisis
Reaksi hidrolisis dapat berlangsung dengan beberapa bahan kimia awal atau reaktan. Berdasarkan jenis reaktan awal, sebenarnya hidrolisis dapat dibedakan menjadi banyak jenis namun pada kali ini akan dibahas hanya jenis hidrolisis garam saja karena hidrolisis garam ini yang paling banyak diterapkan dalam kimia;
-
Garam Parsial (Asam Lemah-Basa Kuat)
Hidrolisis parsial terjadi ketika suatu garam yang terbentuk dari reaksi asam basa dimana asam lemah dan basa kuat dilarukan di dalam air, maka yang terjadi yaitu kation dari basa tidak dapat terhidrolisis, sedangkan anion asam kuat yang akan mengalami proses hidrolisis. Karena tidak semua bagian terhidrolisis, maka dikatakan bahwa proses tersebut hidrolisis parsial.
Sebagai contoh rumus penghitungan garamnya:
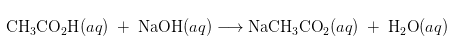
Pada reaksi tersebut, larutan garam mengandung ion natrium dan ion asetat. Ion natrium sebagai asam konjugasi dari basa kuat tidak memiliki pengaruh dalam keasaman larutan. Namun, ion asetat sebagai basa konjugasi dari asam lemah bereaksi dengan air dan meningkatkan pH larutan menjadi basa.
![]()
Konstanta kesetimbanan untuk reaksi ini merupakan konstanta ionisasi Kb untuk basa CH3COO–. Nilai Kb dapat dihitung berdasarkan nilai konstanta ionisasi air (Kw) dan Ka.

Dengan M adalah konsentrasi dari garam.
-
Garam Parsial (Asam Kuat-Basa Lemah)
Hidrolisis ini terjadi ketika garam yang dapat dilihat dari indikator asam basa dimana asam kuat dan basa lemah dilarutkan dalam air. Sebagai contoh yaitu ketika garam ammonium klorida (NH4Cl) terbentuk dari reaksi basa lemah ammonia dengan asam kuat HCl:
![]()
Larutan mengandung ion ammonium (NH4+) dan ion klorida (Cl–). Dimana ion klorida tidak memiliki pengaruh terhadap keasaman larutan meskipun HCl merupakan asam kuat. Namun, ion ammonium yang merupakan asam konjugasi dari amonia bereaksi dengan air membentuk ion hidronium (H3O+) yang memberikan suasana asam pada larutan.
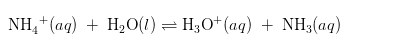
Konstanta kesetimbangan untuk reaksi ini juga sama dengan konstanta ionisasi disebut Ka untuk asam NH4+ .

Dengan M adalah konsentrasi garam.
-
Garam Total (Asam Lemah-Basa Lemah)
Berbeda dengan hidrolisis sebagian yang sudah dibahas, garam yang dihasilkan dari reaksi antara asam lemah dan basa lemah ketika dilarukan ke dalam air maka akan terjadi hidrolisis total. Ini disebabkan karena baik ion positif dari basa lemah maupun ion negatif dari asam lemah memungkinkan untuk terjadinya hidrolisis.
Sebagai contoh yaitu reaksi antara asam asetat yang merupakan asam lemah dengan amonium hidroksida yang merupakan basa lemah menghasilkan garam amonium asetat dan melepas air.
CH3COOH + NH4OH → CH3COONH4 + H2O
Dalam air, baik itu anion CH3COO– maupun kation NH4+ dari amonium astat dapat terhidrolisis dengan masing masing menghasilkan suasana basa dan asam :
CH3COO– + H2O ⇌ CH3COOH + OH–
NH4+ + H2O ⇌ NH4OH + H+
Konstanta kesetimbangan atau tetapan hidrolisis dalam reaksi ini disebut Kh yang berbeda dengan hidrolisis sebagian.

Manfaat Reaksi Hidrolisis
Reaksi hidrolisis ini banyak diterapkan dalam kehidupan sehari hari, berikut ini beberapa contoh manfaat dari hidrolisis dalam kehidupan:
- Hidrolisis berperan dalam pembentukan garam dapur (NaCl) yang merupakan reaksi antara basa kuat dengan asam kuat. Garam dapur ini banyak digunakan sebagai bahan penyedap dalam makanan.
- Dalam bidang pertanian, hidrolisis juga banyak diterapkan dalam prinsip kerja pupuk seperti (NH4)2SO4 yang mampu menurunkan pH tanah sehingga cocok digunakan untuk menanam tanaman tertentu.
- Dalam sistem pencernaan manusia, hidrolisis juga sangat berperan dalam proses pencernaan. Air berperan memecah senyawa dari makanan menjadi senyawa yang lebih sederhana sehingga dapat dicerna tubuh.
Contoh Soal Hidrolisis dan Jawabannya
Agar lebih mudah untuk memehami berbagai rangkaian penjelasan diatas, berikut ini adalah contoh soal dan pembahasan tentang hidrolisis. Antara lain;
-
Tentukan pH dari 0.05 M larutan amonium klorida dengan Ka NH4+ adalah 5.65 x 10-10
Jawab :
- Reaksi yang terjadi : NH4+ + H2O ⇌ NH3 + H3O+
- Rumus dari Ka NH4+
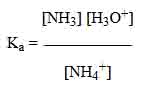
Masukkan angka yang tersedia ke dalam persamaan di atas dengan yang tidak diketahui = X
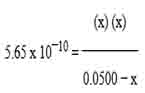
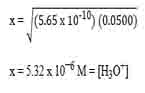
Karena konstanta reaksi antara NH3 , H3O+ dan NH4+ adalah 1 atau sama, maka ketiganya memiliki konsentrasi yang sama yaitu X.
- Selanjutnya, pH dapat dihitung dengan pH = – log [H+]
-
Berapa pH dari 0.1 M larutan metil amonium klorida dengan Ka CH3NH3+ 2.7 x 10-11
Jawab :
- Tentukan reaksi kimianya
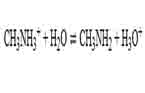
- Persamaan Ka dari CH3NH3+
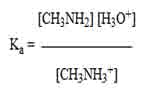
Jawab :
- Reaksi yang terjadi : NH4+ + H2O ⇌ NH3 + H3O+
- Rumus dari Ka NH4+

Hidrolisis dalam Kehidupan Sehari-hari
Adapun untuk contoh reaksi hidrolisis dalam kehidupan sehari-hari. Misalnya saja;
-
Garam dalam Air
Contoh paling sederhana dari hidrolisis adalah proses pelarutan garam dalam air. Garam seperti NaCl merupakan contoh senyawa yang mudah larut dalam air. Ketika suatu garam ditambahkan air, maka NaCl tersebut akan terionisasi atau terdisosiasi dalam air menjadi ion natrium (Na+) dan ion klorida (Cl–).
Arti ion natrium akan lebih tertarik terhadap ion negatif dari air yaitu ion hidroksida, sedangkan ion klorida akan tertarik ke ion hidrogen dari air.
Persamaan dasar dari reaksi dalam rumus hidrolisis dapat digambarkan sebagai berikut
AB + HOH ⇌ AH + BOH
AB merupakan bahan awal yang bereaksi dengan HOH atau H2O yaitu air, hasil reaksi ini AH dan juga BOH yang merupakan hasil hidrolisis. Namun reaksi ini juga dapat berlangsung ke arah sebaliknya dengan disebut reaksi kondensasi.
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa reaksi hidrolisis sangat berguna dalam bidang kimia dan biologi. Aplikasi biologis untuk proses hidrolisis ini seperti dalam metabolisme yang terjadi pada suatu oranisme atau makhluk hidup. Hal paling esensial dalam biologi yang melibatkan reaksi hidrolisis adalah pemecahan ATP yang merupakan suatu sumber energi utama tubuh manusia sehingga ATP tersebut dapat digunakan.
Reaksi hidrolisis dapat menjadi kebalikan dari reaksi kondensasi di mana dua molekul bergabung bersama menjadi lebih besar dan mengeluarkan molekul air. Jadi hidrolisis menambah air untuk memecah, sedangkan kondensasi menumpuk dengan menghilangkan air dan pelarut lainnya. Beberapa reaksi hidrasi adalah hidrolisis.
Disisi lain, hidrolisis biologis adalah pembelahan biomolekul di mana molekul air dikonsumsi untuk mempengaruhi pemisahan molekul yang lebih besar menjadi bagian-bagian komponen. Ketika karbohidrat dipecah menjadi molekul gula komponennya oleh hidrolisis (mis. Sukrosa dipecah menjadi glukosa dan fruktosa), ini dikenal sebagai sakarifikasi.
Nah, itulah tadi uraian bahasan yang bisa kami lakukan kepada kalian, berkaitan dengan pengertian hidrolisis menurut para ahli, macam, manfaat, rumus penghitungan, dan contoh soal beserta jawabannya dalam keseharian. Semoga membantu.


