Isotop diakui atapun tidak menjadi bagian dari bentuk partikel atom dan sistem periodik unsur dimana istilah ini merupakan suatu hal dasar yang harus dikuasai dalam penerapan kimia. Bahkan pada tingkat dasar, materi menjadi penyusun kehidupan dimana materi menjadi suatu zat yang menempati ruang dan memiliki massa. Unsur adalah bentuk materi yang unik dengan sifat kimia, fisik, dan karakteristik tertentu yang tidak dapat diurai lagi menjadi zat yang lebih kecil dengan makna reaksi kimia.
Saat ini terdapat sebanyak 118 unsur, namun hanya terdapat 98 unsur yang terbentuk secara alami dan dapat ditemukan. Sedangkan unsur unsur lainnya membutuhkan sintesis pada laboratorium untuk mendapatkannya. Selain itu, terdapat juga unsur yang tidak stabil sehingga unsur tersebut dapat berubah dengan mudah dan tidak dapat ditemukan dalam keadaan murni atau bebas di alam.
Isotop
Pada kenyataannya pada saat ini terdapat 275 isotop dari 81 unsur yang stabil dan juga terdapat 800 isotop radioaktif dimana beberapa terbentuk secara alami dan beberapa lainnya dibuat secara sintetik. Setiap unsur pada tabel periodik memiliki beberapa isotop.
Pengecualian terdapat pada isotop hidrogen dimana jumlah neutron akan berpengaruh ke dalam ukuran inti atom hidrogen. Sifat fisik isotop berbeda antara satu dengan yang lain bergantung dari massa atomnya. Pemisahan isotop untuk setiap unsur dapat dilakukan dengan menggunakan destilasi fraksinasi maupun difusi sehingga didapat unsur yang murni tanpa keberadaan isotopnya.
Pengertian Isotop
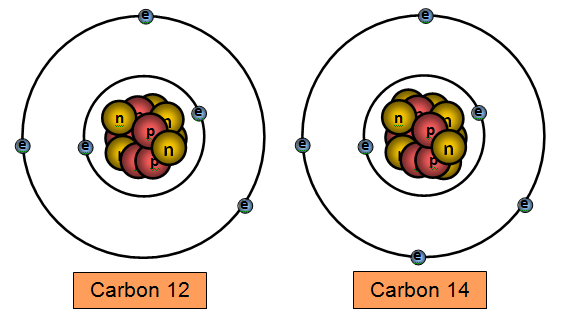
Isotop adalah bentuk unsur yang memiliki jumlah proton sama namun memiliki jumlah neutron yang berbeda. Seperti yang kita tahu bahwa beberapa elemen seperti karbon, kalium, dan uranium memiliki isotop alami dimana karbon-12 memiliki 6 proton, 6 neutron, dan 6 elektron.
Oleh karena itu karbon memiliki massa 12 yang merupakan total dari proton dan neutron. Selain itu, terdapat pula karbon-14 yang memiliki 6 proton, 8 neutron, dan 6 neutron dimana massa 14 didapat dari total proton dan neutron. Dalam hal ini karbon-12 dan karbon-14 dikatakan sebagai suatu isotop.
Suatu unsur yang memiliki isotop berbentuk campuran dari isotop isotopnya. Contohnya yaitu ketika kita berbicara tentang atom karbon, maka unsur tersebut berupa campuran antara karbon-12, karbon-13 bahkan karbon-14. Setiap atom yang memiliki isotop juga demikian, yang membedakan hanya jumlah dan prosentasenya atau kelimpahan relatif. Pada umumnya, kelimpahan realtif isotop suatu unsur telah diketahui sehingga kita dapat memperhitungkan unsur aslinya.
Bentuk Penulisan Isotop
Jenis penulisan isotop biasanya dengan nomor massa dari unsur setelah nama ataupun simbol dari unsur tersebut. Sebagai contoh, isotop dengan 6 proton dan 6 neutron yaitu karbon-12 atau C-12. Isotop karbon dengan 6 proton dan 7 neutron adalah karbon-13 atau C-13.
Massa isotop bisa sama meskipun unsurnya berbeda, contohnya yaitu C-14 dan N-14. Selain itu, isotop juga dapat dituliskan pada bagian kiri atas dari simbol unsur. Sebagai contoh yaitu isotop dari hidrogen yang dapat dituliskan 11H, 21H, dan 31H.
Kegunaan Isotop
Adapun manfaat yang bisa didapatkan dari isotop dalam ilmu kimia ini, antara lain;
-
Menentukan Usia Benda Tertentu
Isotop dari unsur radioaktif dapat berguna untuk menentukan usia benda tertentu. Suatu unsur radioaktif mampu mengalami peluruhan dengan waktu paruh tertentu yang tidak terpengaruh oleh faktor lingkungan, dalam hal ini isotop bertindak sebagai jam internal.
Sebagai contoh, pada analisis sebuah batu ditemukan kandungan uranium-235 dan sejumlah isotopnya. Maka kita dapat menyimpulkan bahwa sebagian unsur uranium-235 asli telah mengalami peluruhan radioaktif. Jika setengah dari uranium telah meluruh, maka batu tersebut akan memiliki usia setengah dari uranium-235 atau sekitar 4,5 x 109 tahun. Banyak analisis seperti ini yang memanfaatkan radioisotop.
Dalam penentuan artefak, karbon-14 menjadi unsur yang sangat berguna dan berperan penting. Karbon-14 diproduksi secara alami di atmosfer dalam jumlah kecil dan unsur ini juga terkandung ke dalam jaringan makhluk hidup yang akan berkembang dalam tingkat yang konstan dan jumlahnya rendah.
Ketika makhluk hidup mati, maka ia tidak akan lagi memperoleh karbon-14 sehingga karbon-14 yang telah ada di dalam jaringan akan meluruh. Hal ini dapat digunakan dalam penentuan artefak yang pernah hidup tersebut.
-
Iradiasi Makanan
Radiasi yang dipancarkan oleh beberapa unsur radioaktif dapat digunakan untuk membunuh mikroorganisme yang tidak diinginkan pada berbagai bahan makanan, tujuan akhirnya adalah untuk memperpanjang usia penyimpanan bahan makanan tersebut. Produk bahan makanan mentah dapat diiradiasi dengan emisi unsur kobalt-60 atau cesium-137.
Paparan radiasi ini dapat membunuh banyak bakteri penyebab pembusukan sehingga hasilnya akan didapat bahan makanan yang tetap segar dan tahan lama. Telur, daging sapi, daging babi, daging unggas, dan sayur-sayuran dapat diawetkan dengan cara ini.
Sebagai catatan bahwa pemberian iradiasi pada makanan tidak akan menjadikan makanan itu menjadi radioaktif sehingga tetap aman untuk dikonsumsi.
-
Aplikasi Medis
Isotop radioaktif memiliki banyak aplikasi dalam bidang medis untuk keperluan diagnosa dan mengobati penyakit tertentu. Salah satu contoh aplikasi diagnostik yang menggunakan isotop radioaktif yaitu dalam pengujian aktivitas kelenjar tiroid menggunakan unsur radioaktif yodium-131.
Kelenjar tiroid pada leher adalah salah satu dari sedikit bagian di tubuh yang mengandung yodium dengan konsentrasi rendah namun signifikan. Untuk mengevaluasi aktivitas tiroidnya, yodium-131 dengan dosis tertentu diberikan kepada pasien dan pada hari berikutnya akan dilakukan pemindaian untuk mengukur jumlah radioaktivitas dalam kelenjar tiroid.
Jumlah yodium radioaktif yang terkumpul disana secara langsung akan berkaitan dengan aktivitas tiroid yang memungkinkan dokter untuk mendiagnosis hipertiroidisme atau hipotiroidisme. Selain tiroid, organ tubuh lain seperti tulang, jantung, hati, otak, paru-paru, dan lain sebagainya juga dapat dilakukan pencitraan dengan cara serupa menggunakan isotop radioaktif yan sesuai.
-
Penentuan Mekanisme Reaksi
Kegunaan lain dari unsur isotop adalah digunakan dalam menentukan mekanisme reaksi tertentu melalui pelabelan radioisotop. Suatu senyawa dapat tersusun oleh unsur yang telah dibedakan dengan menggunakan isotopnya. Cara ini dapat digunakan dalam melacak bagian isotop melalui reaksi atau jalur metabolisme tertentu jika reaksi yang terlibat adalah reaksi dalam contoh biokimia.
Hal ini dapat mengarah pada informasi tentang identitas produk reaksi dan juga memberikan informasi mengenai mekansime reaksi atau jalur biokimia yang digunakan. Metode ini biasa digunakan dalam kimia organik dan biokimia.
Reaktan yang diberi label dengan mengganti atom tertentu dengan isotopnya dan kemudian reaksi dibiarkan terjadi maka akan dihasilkan produk yang dapat diketahui posisi isotopnya. Posisi radioisotop tersebut dapat dibedakan dengan unsur aslinya dengan metode spektrometri massa ataupun NMR.
Contoh Soal dan Jawabannya
Untuk contoh soal serta pembahasan lengkapnya dalam Isotop ini, antara lain adalah sebagai berikut;
1). Suatu atom oksigen diketahui memiliki isotop dengan kelimpahan 168O 99.76% ; 178O 0.04% ; dan 189O 0.2%. Jika diketahui keberadaan oksigen sebanyak 5 gram, tentukan komposisi penyusun oksigen tersebut berdasarkan kelimpahan relatif isotopnya !
5 gram oksigen tersebut terdiri dari campuran 168O 99.76% ; 178O 0.04% ; dan 189O 0.2%. Untuk menentukan komposisinya dapat dilakukan dengan perhitungan berdasarkan persen kelimpahan relatifnya.
Massa 168O = 99.76 % x 5 gram = 4.988 gram
Massa 178O = 0.04 % x 5 gram = 0.002 gram
Massa 188O = 0.2 % x 5 gram = 0.01 gram
Jadi oksigen tersebut tersusun dari 4.988 gram 168O ; 0.002 gram 178O ; dan 0.01 gram 188O.
2). Diketahui atom galium terdiri dari Ga-69 dan Ga-71 yang memiliki massa atom relatif sebesar 69.8. Berdasarkan data tersebut tentukan kelimpahan relatif dari isotop Ga-71 dalam campuran tersebut !
Massa atom relatif 69.8 yang berarti rata rata massa atom galium dari isotopnya adalah 69.8.
Misalkan Z adalah kelimpahan realtif Ga-69, maka
Z% x 69 + (100-Z)% x 71 = 69.8
69Z% + 7100 – 71Z = 69.8
69Z + 7100 – 71Z = 6980
-2Z = -120
Z = 60
Maka untuk kelimpahan relatig Ga-71 = 100-60 = 40%.
Nah, itulah tadi serangkain artikel yang bisa kami berikan terkait dengan pengertian isotop, jenis, kegunaan, contoh soal dan jawabannya. Semoga melalui tulisan ini bisa memberikan wawasan serta memberikan referensi mengenai mata pelajaran kimia.