Konfigurasi elektron bisa dikatakan sebagai konsep dasar yang harus dipelajari untuk memahami secara lebih detail mengenai unsur atom, mekanika bilangan kuantum, dan bagaimana suatu jenis partikel atom dapat berikatan.
Alasannya karena setiap atom memiliki konfigurasi elektronnya masing-masing yang mempengaruhi sifat dari tiap atom tersebut. Oleh karena itulah sangat penting untuk aturan-aturan dalam pengisian konfigurasi elektron dari suatu atom
Konfigurasi Elektron
Sel yang ada dalam tubuh manusia adalah salah satu partikel yang menerapkan teori mekanika kuantum. Sehingga prihal ini konfigurasi elektron adalah cara sederhana untuk menuliskan lokasi semua elektron dalam satu atom tertentu.
Seperti yang telah dipahami bahwa proton yang bermuatan positif dalam inti atom cenderung menarik elektron yang bermuatan negatif ke arahnya. Disini semua elektron menempel pada atom karena ketertarikannya dengan proton tersebut, sementara itu antar elektron akan mengalami gaya tolak menolak karena muatan yang sama yaitu negatif dan menyebabkan penyebaran elektron di sekitar inti atom memiliki pola tertentu yang teratur.
Disini lainnya, penyebaran elektron tersebut menghasilkan struktur geometris yang disebut orbital, dimana orbital tersebut mewakili daerah yang berada diluar inti namun masih terdapat elektron disana. Oleh karena itu orbital menjadi daerah tempat berlokasinya suatu elektron dalam waktu tertentu. Ketika membentuk ikatan dengan atom lain, maka obital dapat digunakan oleh dua elektron dari atom yang berbeda jika ikatan tersebut merupakan ikatan kovalen.
Pengertian Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron dalam tingkat energi di sekitar inti atom, sehingga menurut teori atom keberadaan elektron menempati beberapa tingkat dari kulit pertama yang terdekat dengan inti yaitu kulit K hingga kulit ke tujuh Q yang memiliki letak paling jauh dari inti. Oleh karena itulah konfigurasi elektron disempurnakan dengan model mekanika kuantum yang menggunakan 4 jenis kulit untuk menggambarkan orbital elektron dalam suatu atom.
Yang perlu dipahami bahwa dalam teori lama, natrium yang memiliki total 11 elektron akan memiliki konfigurasi elektron 2 8 1 dengan masing masing berada pada kulit K L M. Sedangkan untuk teori mekanika kuantum yang baru, natrium memiliki konfigurasi yaitu 1s2 2s2 sp6 3s1.
Dengan subkulit s dan p dan angka didepan menunjukkan tingkat energi yang berbeda. Namun setiap subkulit memiliki kapasitas maksimal untuk dapat menampung elektron.
- Subkulit s dapat menampung maksimal 2 elektron
- Subkulit p dapat menampung maksimal 6 elektron
- Subkulit d dapat menampung maksimal 10 elektron
- Subkulit f dapat menampung maksimal 14 elektron
Cara Menentukan Konfigurasi Elektron
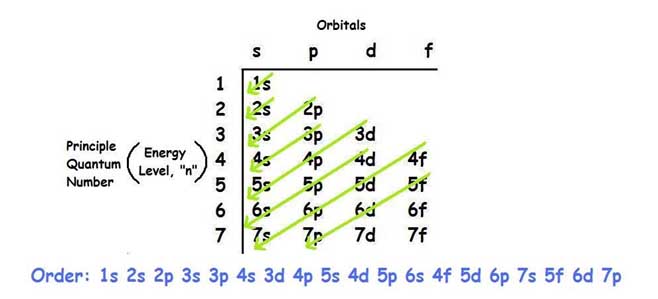
Adapun untuk membuat konfigurasi elektron, cara termudah adalah menggunakan tabel urutan konfigurasi elektron untuk membantu anda dalam menentukan urutan kulit dan orbital yang tersedia untuk elektron. Tabel ini mudah diingat dan memungkinkan untuk membuat konfigurasi elektron dari setiap atom yang diberikan dengan tentunya menggunakan prinsip jumlah maksimal subkulit yang dapat ditempati oleh elektron.
Berikut ini tabel untuk membantu menentukan konfigurasi elektron:

Cara menggunakan tabel ini cukup mudah karena anda hanya perlu mengurutkan sesuai anak panah yang ada hingga jumlah elektron dari atom tersebut habis. Setelah anda menggambar tabel bantuan tersebut, anda cukup mengikuti anak panah mulai dari atas yaitu urutan pertama orbital 1s diikuti 2s, 2p, 3s, 3p, dan seterusnya.
Sembari anda mengurutkan orbital yang digunakan, anda harus mengisinya dengan elektron sesuai aturan yang membatasi jumlah maksimal untuk setiap orbital ditempati elektron.
Peletakan jumlah elektron yaitu berada di posisi superskrip atau dibagian atas setelah huruf yang menunjukkan orbital. Lakukan pengisian elektron sesuai jumlah maksimal tiap orbital sampai jumlah totalnya sama dengan total elektron dari atom.
Sebagai contoh berikut yaitu untuk menentukan orbital dari atom tembaga (Cu) yang memiliki 29 elektron.
- Step pertama adalah melihat tabel untuk bantuan membuat konfigurasi elektron.
- Step kedua yaitu menuliskan konfigurasi elektronnya dari orbital paling awal dengan dilengkapi jumlah elektron yang menempatinya.
Cu : 1s2 2s2 2p6 3s2 3p6 4s2 3d9
Pada konfigurasi tersebut jika kita total jumlah angka yang berada pada posisi superskrip yang menunjukkan jumlah elektron adalah totalnya 29 dimana angka tersebut sesuai dengan jumlah elektron pada Cu.
Untuk menentukan orbital atom dalam bentuk ion juga dapat dengan menggunakan cara yang sama. Dalam kondisi ion, suatu atom mengalami kehilangan atau penambahan elektron dengan jumlah elektron yang hilang atau bertambah sesuai dengan muatannya.
Ketika ion tersebut bermuatan 2+ maka atom kehilangan elektron sebanyak 2 elektron, sedangkan ketika ion bermuatan 1- maka atom tersebut mengalami penambahan 1 elektron.
Aturan dalam Konfigurasi Elektron
Adapun untuk aturan konfigurasi elektron yang telah legal menjadi pedoman dalam penghitungan. Antara lain;
-
Prinsip Aufbau
Prinsip aufbau menyatakan bahwa elektron menempati suatu orbital dengan urutan peningkatan energi tertentu. Urutan energi berdasarkan aufbau mengikuti urutan berikut:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p
Urutan tersebut merupakan sama dengan tabel yang telah diberikan sebelumnya, untuk mempermudah dalam pembuatannya anda dapat menggunakan tabel tersebut.
Aturan ini juga mengikat untuk pengisian elektron harus berada pada tingkat energi yang paling rendah terlebih dahulu sebelum ke tingkat yang lebih tinggi, dengan kata lain bahwa orbital dengan tingkat energi yang lebih rendah harus dipenuhi terlebih dahulu.
Terdapat beberapa pengecualian seperti pada orbital 4s yang ternyata memiliki tingkat energi yang lebih rendah daripada 3d, hal itu dikarenakan elektron pada orbital 3d memiliki kemungkinan lebih besar untuk ditemukan pada dekat inti, karena itu mereka akan saling tolak menolak dengan lebih kuat sehingga energi dari 3d akan lebih tinggi daripada 4s.
-
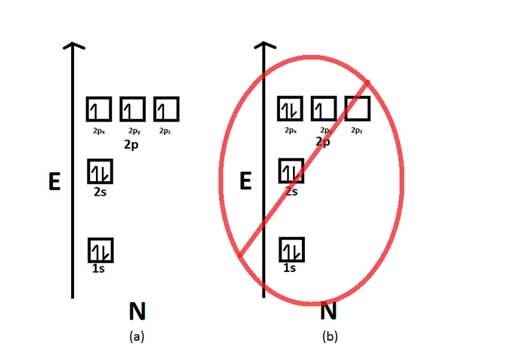
Aturan Hunds
Aturan Hunds menyatakan bahwa ketika elektron menempati orbital sama, maka mereka harus menempati sub-orbital yang kosong terlebih dahulu sebelum mengisi orbital yang sama atau elektron cenderung untuk tidak berpasangan dalam satu orbital.
Misalnya ketika terdapat 2 elektron yang akan menempati orbital p, maka orbital p yang terdiri dari px, py dan pz akan cenderung membagi 2 elektron tersebut ke dalam 2 orbital yang berbeda misalnya 1 elektron ke dalam px dan satu elektron lain ke dalam py daripada menempatkan kedua elektron dalam satu sub-orbital yang sama.
-
Larangan Pauli
Wolfgng Pauli menyatakan bahwa setiap elektron dapat digambarkan dengan empat bilangan kuantum yang berbeda dan unik. Oleh karena itu, jika dua elektron menempati orbital yang sama, maka elektron tersebut akan memiliki bilangan kuantum spin atau putaran yang berbeda.
Dengan kata lain, pauli menyatakan bahwa tidak ada elektron yang memiliki 4 bilangan kuantum yang sama. Ketika suatu elektron memiliki kuantum utama (n) sama, bilangan kuantum momentum sudut (l) sama, dan bilangan kuantum magnetik (m) sama, maka mereka akan memiliki bilangan kuantum spin (s) yang berbeda yaitu bernilai s=+1/2 dan s=-1/2.
-
Aturan Penuh/Setengah Penuh
Aturan penuh dan setengah penuh pada konfigurasi elektron dimana aturan ini menyatakan bahwa suatu elektron dapat berpindah ke orbital lain untuk mencapai susunan yang lebih stabil. Aturan penuh/setengah penuh ini diterapkan untuk konfigurasi elektron yang memiliki akhir yaitu pada sub-kulit d.
Sebagai contoh yaitu pada atom Cu yang memiliki konfigurasi akhir pada orbital 3d. Jika kita menggambarkan konfigurasi Cu tanpa aturan penuh/setengah penuh yaitu memiliki konfigurasi berikut:
Cu : 1s2 2s2 2p6 3s2 3p6 4s2 3d9
Namun dengan aturan setengah penuh, orbital 3d cenderung mengambil elektron dari 4s untuk mencapai total 10 elektron.
Cu : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Contoh Soal Konfigurasi Elektron
Adapun untuk beragam contoh soal dan jawabannya tentang konfigurasi eletron, antara lain sebagai berikut;
- Tuliskan konfigurasi elektron atom Karbon
C = 6 elektron
C : 1s2 2s2 2p2
- Tentukan konfigurasi elektron ion Fe3+
Fe = 26 elektron, maka Fe2+ = 23 elektron
Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d5
- Tentukan konfigurasi atom Cr
Cr = 24 elektron
Cr : 1s2 2s2 2p6 3s2 3p6 4s2 3d4
Aturan penuh/setengah penuh berlaku pada orbital 3d, sehingga orbitalnya menjadi:
Cr : 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Nah, demikianlah serangkaian materi kimia yang menjelaskan terkait pengertian konfigurasi elektron, cara menentukan konfigurasi elektron, aturan dalam perumusan, contoh soal dan jawaban yang bisa diberikan. Semoga melalui artikel ini bisa memberikan pemahaman.