Mempelajari konfigurasi elektron merupakan hal dasar yang harus dikuasai dalam ilmu kimia. Hal itu karena dengan mengetahui konfigurasi elektron ini maka kita akan dapat mengetahui karakteristik dari suatu atom ataupun ciri ion serta bagaimana kemungkinan reaksi dari atom tersebut.
Konfigurasi elektron berhubungan dengan bagaimana suatu jenis partikel atom dapat berikatan dengan atom lain untuk membentuk suatu senyawa. Oleh karena itu dalam penerapan kimia, materi konfigurasi elektron ini penting dan sangat banyak contoh soal mengenai konfigurasi elektron ini.
Konfigurasi Elektron
Konfigurasi elektron yaitu susunan bagaimana suatu elektron mengelilingi suatu inti atom tertentu. Kita telah mengetahui bahwa atom tersusun oleh inti atom yang dikelilingi oleh elektron dengan jumlah tertentu. Berdasarkan teori atom, elektron akan menempati posisi sesuai dengan orbital atau kulit elektron dengan tingkatan energi tertentu yang berbeda beda. Teori mekanika kuantum telah menyempurnakan dan menjelaskan secara rinci bagaimana suatu elektron berada dalam atom dengan menggunakan sub obrital.
Mekanika kuantum mampu menggambarkan posisi masing masing elektron dalam suatu atom. Hal ini tentu akan sangat membantu memprediksi bagaimana ikatan kimia suatu atom dengan atom lain dalam suatu molekul kimia.
Ikatan kimia pada umumnya terjadi pada elektron terluar yang mengadakan serah terima dengan elektron terluar atom lain yang berikatan. Dengan adanya mekanika kuantum ini kita dapat mengetahui jumlah elektron terluar dari suatu atom dan bagaimana karakteristiknya.
Cara Menentukan Konfigurasi Elektron
Secara umum untuk menentukan konfigurasi elektron yang perlu dilakukan adalah dengan menentukan jumlah elektron dalam atom ataupun ion terlebih dahulu. Jumlah elektron dapat diketahui dari nomor atomnya. Selanjutnya kita perlu memasukkan elektron ke dalam suborbital dalam urutan yang benar. Orbital s berisi 2 elektron, orbital p berisi 6 elektron, orbital d berisi 10 elektron, sedangkan orbital f berisi 14 elektron.
-
Urutan Pengisian Orbital
Salah satu hal penting dalam menentukan konfigurasi elektron yaitu dengan melakukan pengisian elektron dengan urutan orbital yang tepat. Untuk mengisi elektron kalian dapat mengurutkannya sesuai urutan orbital berikut.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Masalah lain yang muncul yaitu mungkin kita akan terlalu sulit untuk menghafalkan urutan tersebut. Berikut ini adalah cara alternatif yang dapat dilakukan untuk mengurutkan orbital dengan tepat tanpa harus mengafal urutan tersebut.
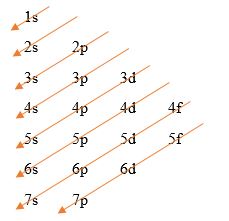
Pertama kita harus menuliskan urutan suborbital untuk tiap level energi secara terorganisir dengan format berurutan kebawah seperti pada gambar. Hal ini tentu akan lebih mudah untuk dituliskan daripada kita harus menghafal setiap urutan orbital. Kita hanya perlu menuliskan angka berurutan kebawah yang mewakili tingkat level energi tiap orbital dan menambahkan suborbital s, p, d, dan f ke kanan untuk mewakili suborbital.
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p
Setelah menuliskan level energi dan juga suborbital, kini kita hanya perlu menggambarkan anak panah dengan arah serong ke kiri bawah secara berurutan. Anak panah berawal dari orbital paling atas yakni 1s, diikuti 2s, kemudian 2p ke 3s dan seterusnya hingga semua bagian yakni berakhir di orbital 7p.
Tabel ini dapat digunakan untuk membantu menuliskan konfigurasi elektron suatu atom ataupun ion tanpa harus menghafalkan urutan suborbitalnya. Cara membaca tabel tersebut yaitu urutan suborbital dimulai dari anak panah pertama paling atas diikuti anak panah bawahnya. Hasilnya akan sama dengan kita menuliskan urutan orbital berikut.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
-
Mengisi Elektron dalam Orbital
Setelah kita mengetahui urutan orbital, maka tahap selanjutnya adalah kita perlu mengisikan elektron yang tersedia dalam orbitalnya. Pengisian elektron dilakukan sesuai jumlah elektron atom ataupun ion yang akan diketahui konfigurasinya. Kita dapat mengetahui jumlah elektron berdasarkan nomor atom dimana nomor atom sama dengan jumlah elektron.
Namun untuk ion kita perlu mengurangi atau menambah jumlah elektron sesuai dengan muatan ionnya. Untuk ion yang bermuatan positif, maka kita perlu mengurangi jumlah elektron dari atom tersebut dengan jumlah muatan ion.
Sedangkan untuk ion yang bermuatan negatif sebaliknya, yakni kita harus menambah jumlah elektron atom awal dengan muatan negatif. Hal itu karena ketika suatu atom bermuatan positif, maka ia mengalami kehilangan elektron. Sedangkan ketika suatu atom bermuatan negatif, maka atom tersebut mengalami penambahan elektron.
Setelah mengetahui jumlah pasti elektronnya, kita isikan ke dalam suborbital yang telah kita urutkan sebelumnya. Aturan pengisiannya yaitu untuk setiap orbital s berisi 2 elektron, orbital p berisi 6 elektron, orbital d berisi 10 elektron, dan orbital f berisi 14 elektron.
Masukkan elektron ke dalam orbital secara urut hingga jumlah elektron habis. Penulisan elektron berada di bagian atas orbital seperti dibawah ini.
1sx
X merupakan jumlah elektron yang ada dalam setiap orbital. Maka contoh penulisan konfigurasi elektron adalah sebagai berikut.
1s2 2s2 2p6 3s2 3p4
-
Pengecualian
Terdapat beberapa aturan pengecualian untuk pengisian konfigurasi elektron. Seperti yang pertama yaitu dalam aturan Aufbau kita diharuskan mengisi elektron dalam orbital sesuai dengan urutan tingkat energinya.
Namun ada pengecualian pada orbital 4s dimana orbital ini memiliki tingkat energi yang lebih rendah jika dibandingkan orbital 3d. Oleh karena itu meskipun memiliki level energi 4 namun orbital 4s harus diisi terlebih dahulu dibandingkan 3d.
Aturan lain yakni aturan hunds dimana dalam satu orbital dengan tingkat energi yang sama, elektron akan menempati setiap orbital hingga setengah penuh terlebih dahulu sebelum menempati orbital yang sama.
Selanjutnya yaitu larangan pauli dimana tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama. Jadi meskipun orbitalnya sama, kedua elektron tersebut akan memiliki bilangan kuantum spin yang berbeda.
Aturan selanjutnya yaitu aturan penuh atau setengah penuh dimana pada aturan ini suatu elektron dapat berpindah ke orbital yang lain untuk mencapai kestabilan. Kestabilan dicapai dengan orbital yang berisi penuh elektron ataupun setengah penuh.
Isi untuk setiap orbital sudah kita bahas di awal yakni 2 untuk s, 6 untuk p, 10 untuk d, dan 14 untuk f. Sebagai contoh ketika kita menuliskan konfigurasi elektron 24Cr.
Tanpa aturan penuh atau setengah penuh kita akan menuliskannya sebagai berikut:
24Cr : 1s2 2s2 2p6 3s2 3p6 4s2 3d4
Namun itu konfigurasi yang salah, maka kita gunakan aturan penuh atau setengah penuh sehingga orbital 3d yang memiliki jumlah maksimal elektron 10 akan lebih stabil untuk berisi 5 atau 10 elektron daripada berisi 4 elektron. Maka dari itu orbital 3d akan mengambil 1 elektron dari 4s untuk mencapai setengah penuh yakni menjadi 5 elektron.
24Cr : 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Contoh Soal Konfigurasi Elektron
- Atom apakah yang memiliki konfigurasi elektron 1s2 2s2 2p6 3s2…?
Untuk menyelesaikan pertanyaan ini kita hanya perlu menghitung jumlah elektron yang ada pada orbital tersebut.
2 + 2 + 6 + 2 = 13
Selanjutnya kita perlu mencari atom apa yang memiliki nomor atom 12, kita dapat mencarinya dalam tabel sistem periodik dan atom tersebut adalah magnesium.
- Tuliskan konfigurasi elektron dari sulfur…?
Pertama kita harus menentukan jumlah elektron dari sulfur. Kita bisa mendapatkannya dari nomor atom sulfur yakni 16 sehingga jumlah elektronnya adalah 16.
Selanjutnya isikan 16 elektron tersebut ke dalam urutan orbital hingga habis.
S : 1s2 2s2 2p6 3s2 3p4
- Tuliskan konfigurasi elektron dari Cu2+
Pertama kita tentukan jumlah elektron Cu yakni 29. Isikan jumlah elektron tersebut ke dalam urutan orbital.
Cu : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Dalam soal diketahui bahwa Cu berupa ion yang bermuatan 2+ sehingga kita harus mengurangi jumlah elektron Cu dengan 2 sehingga total jumlah elektron Cu2+ yaitu 27.
Aturan pengurangannya yaitu dari elektron yang terluar. Dalam hal ini orbital terluar adalah 4s diikuti oleh 3d sehingga 4s yang berisi 1 elektron akan habis elektronnya menjadi 4s0 (tidak perlu dituliskan). Kemudian 3d akan kehilangan 1 buah elektron sehingga menjadi 3d9.
Cu2+ : 1s2 2s2 2p6 3s2 3p6 3d9
Demikian pembahasan yangbbisa kami uraikan pada pembaca tentang cara menentukan konfigurasi elektron dan contoh soal serta jawaban yang bisa diberikannya. Semoga artikel ini dapat menambah pengetahuan serta bermanfaat.