Elektrolisis adalah salah satu penerapan dari sel elektrokimia, sehingga dianggap mampu mengubah energi listrik untuk menghasilkan reaksi kimia yang spontan. Sel elektrokimia artinya adalah merupakan cabang ilmu kimia yang mempelajari hubungan peristiwa penerapan kimia dengan adanya pergerakan elektron.
Sel elektrolisis telah melalui sejarah yang sangat panjang sehingga sekarang sistem ini banyak diterapkan dalam berbagai bidang seperti dalam reaksi kimia untuk sintesis senyawa tertentu ataupun dalam sistem lain. Oleh karena itu perkembangan dari sel elektrolisis memiliki prospek aplikasi yang cukup luas.
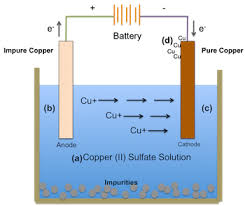
Sel Elektrolisis
Elektrolisis merupakan proses dimana arus listrik dilewatkan melalui suatu zat untuk menghasilkan perubahan kimia atau bermakna reaksi kimia yang spontan. Perubahan kimia tersebut melibatkan terjadinya pertukaran elektron atau dapat disebut juga dengan oksidasi dan reduksi. Dimana oksidasi merupakan proses terjadinya pertambahan elektron sedangkan reduksi adalah proses pengurangan elektron dalam suatu molekul.
Materi lebih lengkap mengenai reaksi reduksi dan oksidasi atau dikenal dengan redoks dapat anda pelajari pada pengertian reaksi redoks. Sebelum anda belajar mengenai elektrolisis lebih jauh, sebaiknya pelajari tentang materi reaksi reduksi dan oksidasi karena materi tersebut akan berhubungan dengan sel elektrolisis.
Dalam sel elektrolisis, reaksi yang terjadi adalah reaksi reduksi dan oksidasi atau disebut redoks dimana reaksi tersebut memanfaatkan terjadinya perpindahan elektron diantara kedua elektroda penghantar.
Di sekitar kita, unsur kimia dan zat kimia hadir dengan memiliki sifat dan kemampuan tersendiri untuk bereaksi dengan unsur atau zat lain. Banyak hal yang dapat menyebabkan suatu reaksi kimia itu terjadi seperti adanya panas, adanya inisiator, adanya katalis dan salah satunya yaitu dengan adanya arus listrik.
Melalui sel elektrolisis, dua zat yang pada mulanya tidak bereaksi maka akan menjadi saling bereaksi ketika elektron dialirkan ke dalamnya. Hal ini berkebalikan dengan sel volta yang menggunakan reaksi kimia untuk menghasilkan arus listrik dan banyak diterapkan dalam prinsip baterai, sedangkan dalam sel elektrolisis ini banyak diterapkan dalam reaksi sintesis untuk mendapatkan logam murni ataupun dalam pelapisan suatu material logam dengan logam lain.
Bentuk Bagian Sel Elektrolisis
Dalam sel elektrolisis terdapat beberapa bagian dari suatu rangkaian yang harus dipenuhi untuk terjadinya peristiwa elektrokimia ini. Bagian bagian utama dari sel elektrolisis yaitu sebagai berikut;
-
Elektroda
Elektroda merupakan merupakan suatu penghantar yang dapat menghantarkan arus listrik dimana pada sel elektrolisis, elektroda dibagi menjadi dua jenis yaitu anoda dan katoda.
Dalam proses elektrolisis, setiap anoda memiliki fungsi tersendiri seperti anoda yang berfungsi sebagai tempat terjadinya reaksi oksidasi dan katoda berfungsi sebagai tempat terjadinya reaksi reduksi. Kedua reaksi ini saling melengkapi dan selalu terjadi secara bersamaan.
Pemilihan elektroda dapat dilihat dari nilai potensial reduksi yang disesuaikan dengan zat yang akan direaksikan. Pada umumnya, elektroda yang dipilih bersifat inert atau tidak bereaksi terhadap larutan ataupun reagen yang digunakan dan juga elektroda bersifat aktif yang dapat bereaksi dengan larutan.
Contoh elektroda inert yang sering digunakan yaitu platina dan karbon, sedangkan elektroda aktif yang sering digunakan yaitu tembaga dan nikel.
-
Elektrolit
Elektrolit adalah suatu larutan yang mampu menghantarkan listrik atau memiliki daya hantar listrik yang tinggi. Pada umumnya, larutan elektrolit memiliki ion ion terlarut dengan konsentrasi yang cukup tinggi sehingga pergerakan ion dalam larutan tersebut berperan dalam sifat konduktivitasnya.
Ion yang berada dalam larutan elektrolit nantinya akan bereaksi dan mengalami reaksi baik reduksi maupun oksidasi yang terjadi di dalam elektroda dengan adanya arus listrik yang dilewatkan. Contoh larutan elektrolit yaitu CuSO4 dan NaCl. Materi mengenai larutan elektrolit dapat dipelajari lebih lanjut pada pengertian larutan elektrolit.
-
Sumber Arus Listrik
Komponen terakhir dari sel elektrolisis adalah sumber arus listrik yang juga sangat penting untuk terjadinya reaksi reduksi dan oksidasi. Arus listrik berupa listrik searah (DC) akan dialirkan melalui kedua elektroda dengan berlawanan muatan ke dalam larutan elektrolit.
Adanya arus listrik tersebut menyebabkan terjadinya pergerakan elektron dari anoda ke katoda yang membuat reaksi pada anoda terjadi secara oksidasi dan pada katoda terjadi reduksi. Tanpa adanya arus listrik, reaksi reduksi dan oksidasi tidak akan berlangsung karena tidak terjadi transfer elektron dalam sistem tersebut.
Jenis Sel Elektrolisis
Sel elektrolisis dapat diklasifikasikan berdasarkan jenis larutan elektrolit maupun berdasarkan elektroda yang digunakan. Berikut ini jenis jenis sel elektrolisis;
-
Sel Elektrolisis Lelehan/Leburan
Sel elektrolisis ini merupakan sistem elektrolisis dengan elektrolit berupa hasil lelehan atau leburan suatu zat tanpa adanya pelarut air.
Dalam jenis elektrolit ini hanya terdapat kation dan anion tanpa adanya molekul H2O. Dalam jenis elektrolisis ini, kation akan direduksi dalam katoda sedangkan anion akan dioksidasi dalam anoda secara langsung. Contoh dari jenis elektrolisis ini adalah dengan menggunakan lelehan NaCl.
-
Sel Elektrolisis Larutan
Elektrolisis jenis ini merupakan lawan dari jenis sebelumnya dimana elektrolit yang digunakan berupa larutan dengan pelarut air. Hal itu berarti dalam elektrolit terdapat anion, kation, dan juga molekul H2O sehingga keberadaan air juga akan diperhitungkan karena dapat terjadi persaingan ketika reaksi berlangsung.
Elektrolisis larutan terbagi menjadi dua jenis yaitu elektrolisis larutan dengan elektroda inert dan dengan elektroda aktif. Contoh dari sel elektrolisis ini adalah dengan menggunakan elektrolit larutan CuSO4.
Cara Kerja Sel Elektrolisis
Dalam sel elektrolisis yang telah dirangkai dengan 3 komponen utama yang lengkap maka sel tersebut sudah dapat dijalankan sebagaimana mestinya. Prinsip kerja dari sel elektrolisis yaitu ketika arus listrik dialirkan dalam elektroda, dimana pada anoda akan diberi muatan positif sedangkan pada katoda akan diberi muatan negatif.
Maka akan terjadi pergerakan elektron akibat adanya arus listrik tersebut dimana elektron bergerak dari anoda menuju katoda. Akibatnya, dalam anoda akan terjadi kekurangan elektron sehingga anoda akan menarik elektron dari larutan elektrolit yang memiliki kandungan anion yang bermuatan negatif dan akan mengalami reaksi oksidasi dengan kehilangan elektron.
Pada katoda memiliki banyak muatan negatif sehingga membutuhkan muatan positif untuk menetralkannya, oleh karena itu katoda cenderung menarik kation dalam elektrolit sehingga kation tersebut akan direduksi dengan menerima elektron.
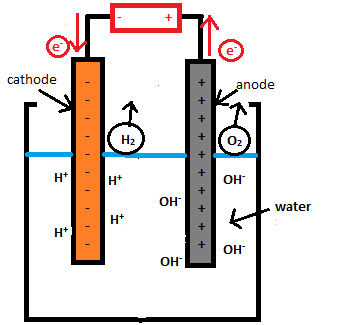
Contoh Sel Elektrolisis
Adapun untuk beragam contoh sel elektrolisis ini antara lain adalah sebagai berikut;
-
Elektroplating/Penyepuhan
Contoh dari penggunaan sel elektrolisis yaitu sebagai metode penyepuhan logam perak dari larutan perak nitrat. Tujuan dilakukannya metode ini yaitu untuk melapisi permukaan logam tertentu dengan perak sehingga memiliki sifat tertentu seperti tidak mudah berkarat, lebih kuat, dan lain lain.
Dalam aplikasi ini, logam yang akan disepuh atau dilapisi ditempatkan sebagai katoda dan akan diberi muatan negatif dari arus listrik. Karena akan dilapisi dengan perak, maka anoda yang digunakan berupa perak dan elektrolit yang digunakan adalah larutan perak nitrat. Ketika arus listrik dialirkan, maka akan terjadi reaksi berikut.
Anoda : Ag Ag+ + e
Katoda : Ag+ + e Ag
Pada katoda akan menghasilkan Ag yang akan melapisi elektroda tersebut.
-
Elektrolisis Aluminium
Contoh selanjutnya yaitu proses elektrolisis aluminium pada proses pembuatan jenis aluminium dari bijihnya. Proses ini dilakukan dengan elektroda karbon yang sifatnya inert atau tidak mudah bereaksi yang ditempatkan sebagai anoda dan katoda.
Ketika arus listrik dialirkan, maka dalam elektrolit Al2O3 akan terjadi reaksi reduksi dan oksidasi. Dalam anoda yang berupa karbon, terjadi reaksi oksidasi dan dalam katoda yang juga karbon terjadi reduksi.
Anoda : 2O2- O2 + 4e–
Katoda : Al3+ + 3e– Al
Aluminium yang dihasilkan berbentuk padat akan mengendap dan menempel di dalam karbon katoda.
Demikian artikel tentang pengertian sel elektrolisis, prinsip kerja dan contohnya. Masih banyak contoh sel elektrolisis yang ada dan digunakan dalam berbagai bidang kehidupan dengan memanfaatkan prinsip reaksi reduksi dan oksidasi.
Oleh karena itu penting bagi anda yang ingin mempelajari kimia untuk mengetahui lebih spesifik tentang elektrokimia dan khususnya yaitu tentang sel elektrolisis. Dalam sel elektrolisis ini juga terkait dengan materi tentang Hukum Faraday karena pada dasarnya prinsip ini juga menerapkan dari Hukum Faraday yang dapat anda pelajari pada materi pengertian elektrokimia (hukum faraday).
Nah, itulah artikel yang menjelaskan tentang pengertian sel elektrolisis, cara kerja, jenis, dan contohnya dalam ilmu kimia. Semoga melalui artikel ini bisa memberikan wawasan serta menambah edukasi mendalam bagi segenap pembaca sekalian.



Apa metode ini bisa di pakai untuk memisahkan unsur CL dari pupuk KCL ,, saya ingin memisahkan unsur kalium yg saya butuhkan ,, terimakasih