Sel volta diakui ataupun tidak, sejatinya menjadi bagian dalam materi dalam arti elektrokimia yang saat ini telah banyak dimanfaatkan dan berperan dalam kehidupan manusia. Elektrokimia sangat berperan dalam bidang energi dimana pada bidang ini para ilmuwan telah banyak mengembangkan berbagai sumber energi untuk menunjang kehidupan manusia.
Maksud reaksi kimia juga tentu terlibat dalam sebuah proses elektrokimia. Pada umumnya kita mengenal reaksi redoks sebagai reaksi yang umum terjadi dalam proses elektrokimia termasuk dalam prinsip penggunaan sel volta.
Sel Volta
Sel volta atau disebut juga dengan sel galvani merupakan proses dimana reaksi kimia yang terjadi mampu menghasilkan suatu energi listrik. Dalam sel volta ini reaksi terjadi diantara konduktor yang saling terhubung dan dalam suatu sistem elektrolit sehingga dapat terjadi aliran listrik melalui elektroda tersebut.
Sel volta juga dapat terjadi dengan adanya reaksi oksidasi dan reduksi atau kita kenal dengan reaksi redoks yang terjadi secara spontan. Secara sederhana, energi listrik dalam sel volta dihasilkan melalui proses transfer elektron yang terjadi ketika reaksi redoks berlangsung. Energi listrik ini dapat kita gunakan dalam berbagai hal seperti sebagai daya dalam gadget, televisi, dan lain sebagainya.
Dalam elektrokimia, kita mengenal dua jenis sel yakni sel volta dan juga sel elektrolisis. Sel volta berbeda dengan sel elektrolisis dimana dalam sel elektrolisis proses yang terjadi yaitu energi listrik yang ada dimanfaatkan untuk mendorong sebuah reaksi kimia yang tidak spontan sehingga dapat berlangsung. Hal ini tentu berkebalikan dengan prinsip pada sel volta.
Pengertian Sel Volta Menurut Para Ahli
Adapun definisi sel volta menurut para ahli, antara lain;
- N.Kristin (2021), Sel volta adalah bagian daripada pembahasan dalam sel elektrokimia yang dapat mampu untuk menghasilkan energi listrik lantaran adanya bagian reaksi redoks yang bersifat spontan.
Teori Sel Volta
Energi listrik yang dihasilkan dalam suatu sel volta atau sel galvani pada umumnya disebabkan dengan adanya energi gibs dari reaksi redoks spontan pada sistem sel volta. Bagaimana suatu sel volta bekerja akan bergantung pada prinsip dimana ketika terdapat dua logam berbeda dalam satu larutan elektrolit, maka logam yang bersifat lebih reaktif akan memiliki tendensi untuk terlarut dalam larutan elektrolit sebagai ion logam positif meninggalkan elektron pada plat logam.
Hal ini akan menyebabkan plat logam juga bersifat reaktif dan bermuatan negatif. Sedangkan logam yang bersifat kurang reaktif akan menarik ion positif yang berada dalam larutan elektrolit dan ion positif ini akan berkumpul dan menempel dalam plat logam sehingga menjadikan plat bermuatan positif.
Contoh kasus sederhana dalam sel volta sederhana yaitu ketika zink terlarut dalam larutan asam sulfat sebagai ion positif Zn2+ atau kation dan kemudian akan bereaksi dengan ion negatif SO4-2 dari asam sulfat sehingga membentuk zink sulfat (ZnSO4).
Dalam waktu yang sama, tembaga sebagai logam yang kurang reaktif dibandingkan zink akan menarik ion positif hidrogen (H+) dari asam sulfat sehingga terdeposit ke dalam plat tembaga.
Semakin banyak ion zink yang terlarut dalam larutan itu berarti semakin banyak elektron yang dilepaskan ke dalam plat zink. Elektron ini kemudian akan bergerak melalui konduktor eksternal yang menghubungkan plat zink dan tembaga.
Zn + H2SO4 → ZnSO4 + H2
Ketika sampai ke plat tembaga, maka elektron ini akan bergabung dengan atom hidrogen yang tadi telah terdeposit dalam plat tembaga dan membentuk atom hidrogen netral.
Teori atom ini kemudian akan membentuk molekul gas hidrogen (H2) yang muncul dari plat tembaga dan terlihat sebagai gelembung udara dalam larutan. Pergerakan elektron yang terjadi dalam konduktor itulah yang menyebabkan sel volta ini dapat menghasilkan arus listrik.
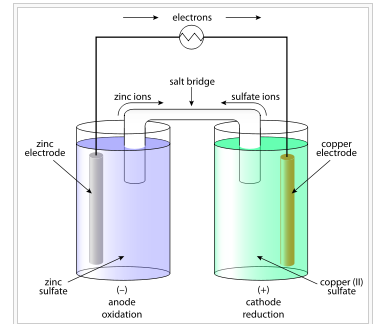
Komponen Sel Volta
-
Anoda
Anoda merupakan bagian elektroda atau plat logam yang mengalami reaksi oksidasi. Dalam contoh sel volta diatas, plat zink merupakan elektroda yang mengalami oksidasi atau bagian anoda. Dalam bagian ini, zink akan teroksidasi dengan melepaskan elektronnya.
-
Katoda
Berbeda dengan anoda, pada katoda terjadi reaksi reduksi. Dalam hal ini, plat Cu merupakan elektroda bagian katoda dimana akan mengalami reaksi reduksi. Reaksi tersebut terjadi ketika ion Cu akan menangkap elektron dalam elektroda.
-
Setengah Sel
Setengah sel merupakan dua bagian utama sel volta yang sejatinya semuanya terpisah dimana pada bagian ini memuat larutan elektrolit dan memungkinkan terjadinya reaksi oksidasi dan reduksi.
-
Jembatan Garam
Bagian selanjutnya yang menjadi bagian utama yaitu jembatan garam. Bagian ini terdiri dari suatu elektrolit yang mampu memungkinkan pergerakan ciri ion dalam larutan secara perlahan. Dalam hal ini, ion zink dan ion sulfat akan bergerak melalui jembatan garam yang menghubungkan dua bagian utama sel volta.
-
Sirkuit Eksternal
Sirkuit eksternal merupakan bagian yang terhubung dengan elektroda. Bagian ini akan mengalirkan elektron dari elektroda satu ke elektroda yang lain. Dengan kata lain bagian ini adalah bagian yang memanfaatkan energi listrik dari sebuah sel volta.
Cara Kerja Sel Volta
Bagaimana suatu sel volta bekerja sehingga mampu menghasilkan energi listrik sesuai dengan prinsip sel volta tersebut. Sel volta melibatkan reaksi kimia yang memungkinkan terjadinya energi listrik di akhir reaksi. Ketika terjadi reaksi redoks, suatu sel volta akan menghasilkan transfer elektron antar elektrodanya yang dapat dikonversi sebagai energi listrik.
Seperti yang telah kita ketahui dalam prinsip sel volta bahwa setiap bagian sel volta akan mengalami reaksi baik itu oksidasi maupun reduksi.
Bagian yang mengalami oksidasi akan melepaskan elektron ke elektroda sedangkan bagian yang mengalami reaksi reduksi akan menangkap elektron dari elektroda. Hal itu memungkinkan pergerakan elektron dari elektroda oksidasi (anoda) ke elektroda reduksi (katoda).
Pergerakan elektron tersebut akan dilewarkan sirkuit eksternal atau dapat kita sebut sebagai bagian yang menggunakan sumber listrik. Sirkuit eksternal tersebut akan memanfaatkan pergerakan elektron sebagai energi listrik.
Kita dapat menempatkan seperti lampu diantara kedua elektroda tersebut sehingga akan melihat lampu menyala ketika elektron bergerak dari satu elektroda ke elektroda lainnya.
Contoh Sel Volta
Penjelasan lebih lengkap untuk contoh sel volta dalam materi kimia, antara lain;
-
Baterai Edison
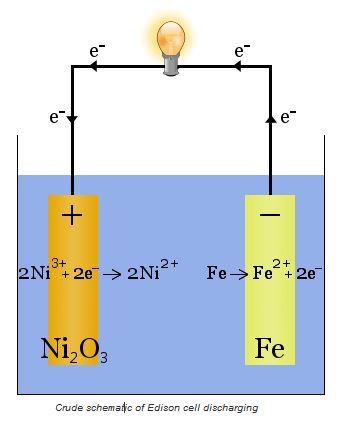
Baterai edison merupakan jenis baterai konvensional yang dapat digunakan berulang dan memiliki prinsip yang sangat sederhana. Baterai edison terdiri dari dua buah elektroda, satu elektroda terbuat dari besi dan elektroda yang lain terbuat dari nikel.
Dalam proses pengisian ulang, akan terbentuk nikel oksida yang mengelilingi elektroda nikel. Proses pengisian ulang ini memanfaatkan prinsip sel volta.
Dalam sel volta baterai edison, larutan elektrolit yang digunakan merupakan ionic liquid yang berupa 20-30 persen kalium hidroksida dalam air. Larutan ini memiliki peran dalam meningkatkan konduktivitas ionik dimana kalium hidroksida tidak dikonsumsi dalam reaksi.
Ketika baterai tersebut digunakan sebagai sumber daya, prinsip sel volta akan digunakan dalam proses ini. Dalam elektroda akan terjadi reaksi berikut.
Ni2O3 + H2O + 2 e– ⇌ 2 NiO + 2 OH–
Fe + 2 OH– ⇌ Fe(OH)2 + 2 e–
Reaksi ini berlangsung dalam kedua elektroda sehingga akan menghasilkan pergerakan elektron dari elektroda besi ke elektroda nikel. Pergerakan elektron inilah yang kita manfaatkan sebagai sumber energi listrik.
-
Baterai Lithium
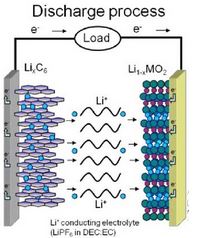
Jika baterai edison merupakan contoh konvensional, maka baterai lithium adalah jenis baterai modern yang saat ini banyak digunakan dalam gadget. Baterai lithium memanfaatkan prinsip sel volta dalam proses kerjanya.
Baterai lithium umumnya berbasis elektroda berpori yang memungkinkan ion lithium untuk bergerak masuk dan keluar dari pori tersebut. Sebagai contoh, sebuah baterai isi ulang lithium ion dapat menggunakan elektroda sebuah grafit, elektroda lithium yang telah di doping dengan kobalt, dan juga elektrolit berupa polioksietilena yang mengandung garam LiPF6.
Ketika baterai tersebut digunakan sebagai sumber daya sebuah alat, atom lithium yang berada dalam bagian struktur grafit sebagai anoda akan teroksidasi dan berubah menjadi sebuah ion lithium sesuai reaksi berikut. Dimana LiC6 merupakan elektroda grafit yang mengandung lithium sedangkan C6 adalah grafit itu sendiri.
LiC6 → C6 + Li+ + e–
Sedangkan pada katoda, ion lithium akan tereduksi dengan adanya kobalt oksida.
CoO2 + Li+ + e– → LiCoO2
Reaksi ini bersifat reversibel atau dapat kembali ke arah sebaliknya sehingga hal ini memungkinkan proses pengisian ulang pada baterai lithium.
Dalam reaksi tersebut dapat kita lihat bahwa sebuah elektron terlibat dimana pada elektroda grafit akan mengalirkan elektron menuju elektroda kobalt sehingga pergerakan elektron tersebut akan menyebabkan adanya energi listrik.
Demikian pembahasan lengkap tentang pengertian sel volta, teori, komponen, cara kerja, dan contohnya dalam berbagai bidang. Semoga melalui artikel yang kami ulasan ini ini dapat menambah pengetahuan serta bermanfaat bagi semua.