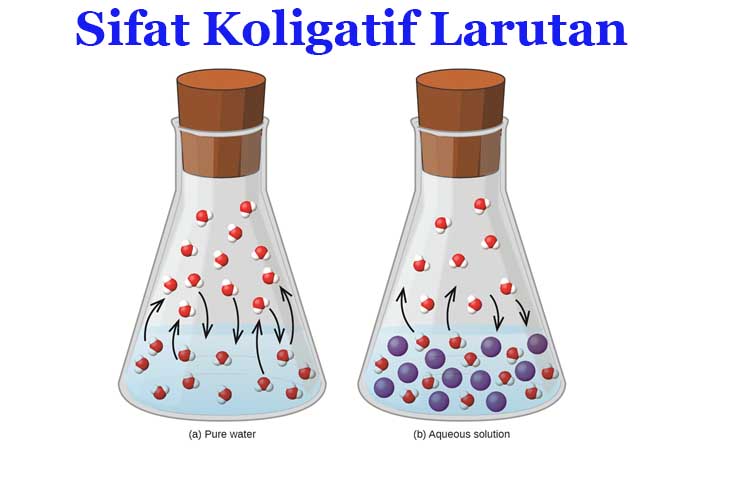
Sifat koligatif adalah sifat alami yang dimiliki oleh suatu larutan dengan zat terlarut tertentu. Pelarut murni akan memiliki sifat yang sangat berbeda daripada sifat pelarut yang sudah dicampur dengan zat terlarut atau disebut dengan larutan, sifat itulah yang disebut dengan sifat koligatif larutan.
Banyak sekali peristiwa yang melibatkan sifat koligatif larutan dan diterapkan dalam kehidupan sehari-hari. Dalam ilmu kimia peristiwa ini juga dipelajari secara khusus dalam sifat koligatif larutan. Pada artikel ini akan dibahas mengenai pengertian sifat koligatif larutan, sifat-sifatnya, serta contoh.
Sifat Koligatif Larutan
Sifat fisik dalam suatu larutan dapat dibagi menjadi dua yaitu sifat luas (massa dan volume) yang tergantung pada ukuran sampel dan sifat intensif (kerapatan dan konsentrasi) yang tidak tergantung ukuran sampel. Selain kedua sifat itu, terdapat sifat ketiga yaitu dikenal dengan sifat koligatif larutan yang bergantung pada rasio jumlah partikel zat terlarut dalam pelarut pada larutan.
Sifat koligatif ini melibatkan jumlah zat terlarut dalam suatu pelarut dimana zat terlarut tersebut akan menentukan bagaimana sifat larutan tersebut. Sifat koligatif juga berhubungan dengan titik didih, titik beku, dan tekanan osmosis dalam suatu larutan.
Adanya zat terlarut tersebut dapat mengubah ketiga parameter diatas sehingga hal ini banyak dimanfaatkan dalam kehidupan manusia.
Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat larutan yang bergantung pada jumlah partikel dalam volume pelarut tertentu dan tidak dipengaruhi oleh massa atau identitas partikel terlarutnya. Untuk setiap perbandingan massa zat terlarut dan pelarut, sifat koligatif larutan berbanding terbalik dengan massa molar zat terlarut. Kata koligatif berasal dari bahasa latin “colligatus” yang artinya “terikat bersama”, hal ini menunjukkan bagaimana sifat pelarut terikat pada konsentrasi zat terlarutnya dalam suatu larutan.
Ketika zat terlarut ditambahkan ke pelarut dengan volume tertentu untuk membuat suatu larutan, partikel terlarut akan memindahkan sebagian pelarut dalam fase cair. Hal ini akan mengurangi konsentrasi pelarut per volume, ini juga akan berhubungan pada jenis partikel dan banyak partikelnya.
Sebagai contoh ketika kita melarutkan CaCl2 maka akan menghasilkan tiga partikel yaitu satu pengertian ion kalsium dan dua ion klorida, sedangkan saat kita melarutkan NaCl hanya akan menghasilkan dua partikel yaitu satu ion natrium dan satu ion klorida. Oleh karena itu, kalsium klorida akan memiliki efek yang lebih besar pada sifat koligatif daripada natrium klorida.
Contoh dari sifat koligatif larutan yaitu penurunan tekanan uap, penurunan titik beku, peningkatan titik didih, dan tekanan osmotik dari suatu larutan.
Fraksi Mol dan Molalitas
Sebelum belajar tentang sifat koligatif larutan, terlebih dahulu kita harus mengenal tentang fraksi mol dan molalitas suatu larutan. Kedua parameter ini akan digunakan dalam menyatakan konsentrasi komponen larutan. Berbeda dengan prinsip stoikiometri yang menggunakan parameter molaritas (M) sebagai konsentrasi, namun dalam koligatif menggunakan fraksi mol (X) dan molalitas (m).
Fraksi mol adalah parameter yang menyatakan ukuran konsentrasi suatu larutan dalam bentuk perbandingan jumlah mol satu komponen terhadap jumlah mol total dalam larutan.
Dalam larutan, fraksi mol dapat dinyatakan sebagai fraksi mol zat terlarut ataupun fraksi mol pelarut dimana keduanya saling melengkapi. Sesuai definisinya yang menyatakan bahwa fraksi mol adalah perbandingan jumlah mol satu komponen terhadap jumlah mol total, maka fraksi mol dapat dirumuskan sebagai berikut:
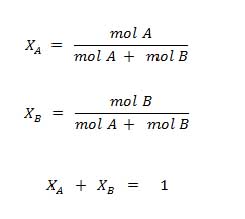
Berdasarkan rumus diatas, XA merupakan fraksi mol untuk zat terlarut sedangkan XB merupakan fraksi mol untuk pelarut atau boleh sebaliknya. Karena keduanya saling melengkapi, maka penjumlahan kedua fraksi tersebut menghasilkan nilai 1.
Molalitas adalah satuan konsentrasi yang didefinisikan sebagai rasio perbandingan jumlah mol zat terlarut terhadap massa pelarut dalam kilogram.
Yang membedakan molalitas (m) dengan molaritas (M) yaitu pada satuan pelarut dimana pada molaritas digunakan satuan per volume pelarut sedangkan pada molalitas digunakan satuan per massa pelarut. Untuk menghitung molalitas suatu larutan dapat digunakan rumus sebagai berikut:
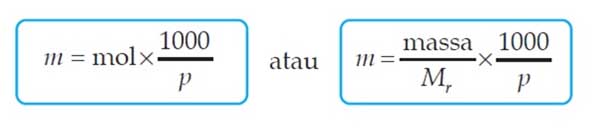
Dimana
- m = Molalitas
- massa = Massa zat terlarut (g)
- Mr = Massa molar zat terlarut (g/mol)
- P = Massa pelarut (g)
Jenis Sifat Koligatif Larutan
Adapun untuk beragam macam sifat dalam kaligatif larutan, antara lain sebagai berikut;
-
Penurunan Tekanan Uap
Penurunan tekanan uap suatu cairan adalah kesetimbangan antara tekanan molekul gas dari cairan itu sendiri. Segelas air yang ditempatkan di ruang terbuka akan menguap dengan sepenuhnya karena tidak tercapai keseimbangan dengan sekitarnya, namun ketika gelas tersebut ditutup maka jumlah uap air akan konstan karena tercapainya keseimbangan.
Hukum Roult menyatakan bahwa tekanan uap pelarut dalam larutan sebanding dengan fraksi mol pelarut dalam larutan, atau dengan kata lain semakin besar fraksi mol zat terlarut maka tekanan uap pelarut akan semakin kecil. Dengan hal tersebut maka perhitungan untuk sifat penurunan tekanan uap yaitu:

Dimana P adalah tekanan uap dan adalah penurunan tekanan uap.
-
Kenaikan Titik Didih
Titik didih suatu larutan selalu lebih tinggi daripada titik didih pelarut murninya. Peristiwa ini dapat dilihat ketika anda memanaskan air murni dengan air yang mengandung garam, maka akan lebih mudah mendidih air murni dibandingkan air garam. Hal itu karena pengaruh adanya zat terlarut dalam suatu larutan yang bersifat non-volatil sehingga menyebabkan naiknya titik didih keseluruhan larutan.
Perhitungan kenaikan titik didih suatu larutan dapat dihitung berdasarkan konsentrasi molalnya. Berikut ini rumus untuk perhitungan kenaikan titik didih larutan non-elektrolit:
Untuk larutan elektrolit:
Dimana ^Tb adalah kenaikan titik didih, Kb adalah konstanta kenaikan titik didih, dan i adalah jumlah ion (misal CaCl2 terdiri ion Ca & 2 ion Cl, maka i = 3).
-
Penurunan Titik Beku
Selain mengalami kenaikan titik didih, suatu larutan juga dapat mengalami penurunan titik beku. Keberadaan zat terlarut dapat menurunkan titik beku larutan relatif terhadap pelarut murninya. Sebagai contoh ketika air murni membeku pada suhu 0, maka jika anda melarutkan garam ke dalam air titik beku akan turun hingga 5.9. Sifat ini biasa digunakan dalam proses pencairan salju menggunakan garam dapur.
-
Tekanan Osmosis
Tekanan osmosis adalah proses dimana pelarut mampu melewati membran semi permeabel dari satu larutan ke larutan lain atau dari pelarut murni ke dalam larutan. Membran semi permeabel merupakan suatu penghalang dimana pada membran ini terdapat zat yang melewatinya dan terdapat zat yang tidak mampu melewatinya. Contoh membran semi permeabel adalah dinding sel dalam makhluk hidup.
Osmosis cenderung mendorong molekul pelarut untuk melewati membran semi permeabel sehingga bergerak dari larutan dengan konsentrasi rendah ke konsentrasi lebih tinggi. Contoh peristiwa ini yaitu proses naiknya air tanah melalui akar menuju seluruh bagian tanaman, penggunaan garam dapur sebagai pengawet makanan, dan proses dalam cuci darah.

Dimana n adalah tekanan osmosis, M adalah konsentrasi zat (Molaritas), R adalah konstanta gas ideal (0,0821 L.atm/mol.K), dan T adalah suhu (K)
Soal Sifat Koligatif Larutan
Adapun untuk memperjelas bagian dalam sifaf koligatif dalam larutan, maka selanjutnya berikut adalah contoh-contoh soal beserta jawabannya.
Demikianlah serangkaian penjelasan terkait dengan pengertian sifat koligatif larutan, jenis, sifat-sifatnya, contoh dan jawabannya. Semoga melalui artikel ini dapat memberikan wawasan serta refrensi mendalam bagi segenap pembaca sekalian.